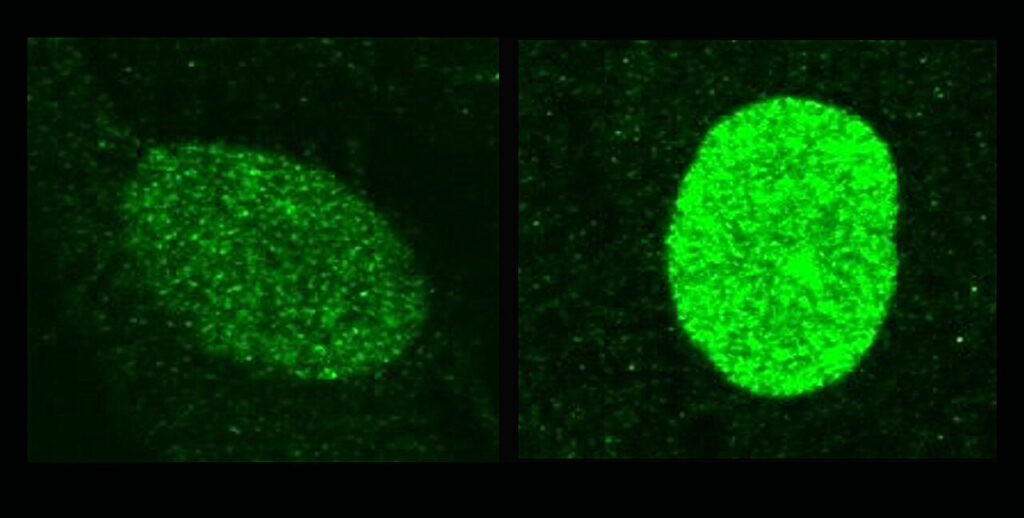
Ces images au microscope montrent comment l'interféron dans le noyau augmente les niveaux de la protéine protectrice IFI16 (colorée en vert) depuis de faibles niveaux de fond (à gauche) jusqu'aux niveaux plus élevés nécessaires pour résister à l'infection herpétique (à droite). Crédit : Centre d'imagerie HMS MicroN / Nicolas Romero Rata
Le virus de l'herpès simplex (HSV) est extrêmement courant et touche près des deux tiers de la population mondiale, selon l'Organisation mondiale de la santé.
Une fois à l’intérieur du corps, le HSV développe une infection latente qui se réveille périodiquement, provoquant des cloques douloureuses sur la peau, généralement autour du nez et de la bouche. Bien qu'il ne s'agisse que d'une simple nuisance pour la plupart des gens, le HSV peut également entraîner des infections oculaires dangereuses et une inflammation du cerveau chez certaines personnes et provoquer des infections potentiellement mortelles chez les nouveau-nés.
Les chercheurs savent depuis longtemps que le virus et le système immunitaire de l’hôte sont en perpétuelle compétition, mais pourquoi cette bataille stagne-t-elle chez la plupart des gens alors qu’elle provoque de graves infections chez d’autres ?
Plus important encore, comment se déroule précisément la bataille au niveau des cellules et des molécules ? Cette question continue de tourmenter les scientifiques et d’entraver la recherche de traitements permettant de prévenir ou de guérir les infections.
Une étude récente menée par des chercheurs de la Harvard Medical School, menée à l'aide de cellules conçues en laboratoire et publiée dans PNASdévoile les manœuvres précises utilisées par l'hôte et l'agent pathogène dans la lutte pour la domination de la cellule.
En outre, la recherche montre comment le système immunitaire maintient le virus à distance dans une bataille qui se déroule au centre de contrôle de la cellule : son noyau.
Les protéines de signalisation immunitaire lancent un appel aux armes
La recherche révèle le rôle clé d’un groupe de protéines de signalisation appelées interférons, qui recrutent d’autres molécules protectrices et empêchent le virus de développer une infection.
Une fois à l'intérieur de l'hôte, le HSV se multiplie en faisant des copies de lui-même à l'intérieur des noyaux des cellules, en utilisant la machinerie génétique de l'hôte. Pour que cela se produise, le virus doit vaincre le système immunitaire de l’hôte. Mais bon nombre des tactiques utilisées par le virus et le système immunitaire dans ce concours sont restées mystérieuses, ce qui rend difficile la conception de médicaments pour aider les patients à vaincre le virus.
Les interférons, nommés pour leur capacité à interférer avec les tentatives des agents pathogènes d'infecter les cellules, sont des molécules de signalisation libérées lorsque le système immunitaire détecte la présence de microbes, tels que des virus. Les signaux de détresse envoyés par les interférons activent des gènes dans cette cellule et dans d’autres cellules qui produisent des protéines, qui à leur tour empêchent les virus de créer une infection.
Plusieurs mécanismes différents utilisés par les interférons pour contrecarrer les virus dans le cytoplasme, le liquide gélatineux qui remplit les cellules, sont bien connus. Mais la façon dont les interférons agissent contre les virus à ADN, ceux qui lancent leur attaque dans le noyau cellulaire, reste insaisissable.
“Nous en savons beaucoup sur la façon dont l'interféron et les stimulants immunitaires agissent contre les virus dans le corps cytoplasmique de la cellule, mais jusqu'à présent, nous en savions très peu sur la manière dont le système immunitaire bloque l'infection virale dans le noyau de la cellule”, a déclaré David, auteur principal de l'étude. Knipe, professeur Higgins de microbiologie et de génétique moléculaire à l'Institut Blavatnik du HMS. “Nos résultats définissent les mécanismes d'action de tout traitement qui induit des interférons et comment ils peuvent prévenir et traiter les infections par le HSV, ainsi que par d'autres virus de l'herpès et virus à ADN nucléaire.”
Knipe a déclaré que les conclusions de ces travaux pourraient également aider les chercheurs à comprendre – et peut-être éventuellement à développer des traitements – d'autres virus à ADN nucléaire, notamment des fauteurs de troubles bien connus comme le virus d'Epstein-Barr, qui provoque la mononucléose ; papillomavirus humain; hépatite B; et la variole.
Ces résultats définissent les mécanismes d'action des traitements à l'interféron pour les maladies à herpèsvirus et d'autres traitements tels que les ligands des récepteurs de type Toll qui ont été testés pour l'herpès, ont indiqué les chercheurs. D'autres nouveaux activateurs d'interférons, tels que les agonistes du CGAS, pourraient également être utilisés pour induire une résistance à l'herpès grâce aux mécanismes nouvellement définis, ont ajouté les chercheurs.
Les chercheurs préviennent que tout nouveau traitement potentiel contre le HSV et d’autres virus à ADN est à ce stade purement conceptuel. De telles approches devraient d’abord être testées sur de petits animaux tels que des souris, puis sur des animaux plus gros et enfin sur des humains.
Cartographier les étapes d’une course aux armements virale
Dans la nouvelle étude, Knipe et la co-auteure Catherine Sodroski, titulaire d'un doctorat HMS. aujourd'hui diplômé des National Institutes of Health, a découvert qu'une protéine hôte appelée IFI16 est recrutée par l'interféron pour aider à empêcher le virus de se reproduire de plusieurs manières.
L’une des stratégies utilisées par IFI16 pour lutter contre le HSV consiste à construire et à maintenir une enveloppe de molécules autour du génome de l’ADN viral. Ce « papier bulle » moléculaire empêche le virus de se déployer. Une fois le virus enveloppé, il ne peut pas activer son ADN pour exprimer ses gènes et faire des copies de lui-même.
Cependant, pour contrer ces manœuvres de protection, le virus produit des molécules appelées VP16 et ICP0 qui peuvent retirer l'emballage, désactiver les molécules protectrices de la cellule hôte et permettre au virus de se reproduire.
Un autre mécanisme utilisé par IFI16 pour lutter contre l'infection par le HSV consiste à neutraliser VP16 et ICP016. Dans des circonstances normales, lorsque la cellule ne se prépare pas à repousser un envahisseur viral, une certaine quantité d’IFI16 est présente dans le noyau. Mais ce niveau de fond d’IFI16 n’est pas suffisant pour combattre les protéines virales auxiliaires et maintenir le virus enveloppé et retenu.
Sans l'appel de l'interféron à la cellule pour envoyer davantage d'IFI16, le virus remporte la course aux armements et infecte la cellule. Cependant, les expériences ont montré que lorsque les signaux d’interféron recrutent des niveaux plus élevés d’IFI16, le système immunitaire gagne.
Cette étude actuelle fait écho à des résultats similaires qui ont révélé des niveaux élevés d'IFI16 dans des échantillons cliniques de tissus où le système immunitaire semblait contrôler avec succès les symptômes du virus HSV-2 étroitement apparenté, fournissant des informations cruciales sur la machinerie moléculaire à l'œuvre pour prévenir les épidémies de symptômes.
Utiliser les connaissances du laboratoire pour améliorer la santé humaine
Knipe dit qu'il s'est intéressé à la biologie des virus de l'herpès alors qu'il était étudiant alors qu'il se remettait d'une mononucléose. Il a transformé cette curiosité en carrière.
Le laboratoire Knipe étudie ce qui se passe au niveau des molécules et des cellules lorsque le HSV provoque des infections symptomatiques et latentes. Il s'intéresse particulièrement à la façon dont le système immunitaire de l'hôte réagit au HSV. Knipe a appliqué les connaissances acquises en étudiant le HSV pour explorer les possibilités d'utiliser le matériel génétique du HSV pour administrer des vaccins contre le VIH, le SRAS, le Nil occidental et l'anthrax.
“Résoudre les énigmes qui sous-tendent la biologie fondamentale de la façon dont ces virus interagissent avec le noyau de la cellule hôte et le système immunitaire est sans cesse fascinant, et trouver de nouvelles façons d'appliquer ces connaissances à la lutte contre les maladies est sans cesse gratifiant”, a déclaré Knipe. “Le plus excitant, c'est que nous ne faisons qu'effleurer la surface des connaissances approfondies que nous pouvons exploiter pour ce combat.”
Plus d'information:
Catherine N. Sodroski et al, Le produit génique stimulé par l'interféron nucléaire maintient l'hétérochromatine sur le génome viral de l'herpès simplex pour limiter l'infection lytique, Actes de l'Académie nationale des sciences (2023). DOI : 10.1073/pnas.2310996120
Fourni par la faculté de médecine de Harvard
Citation: Comment le système immunitaire lutte pour garder l'herpès à distance (14 décembre 2023) récupéré le 14 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.