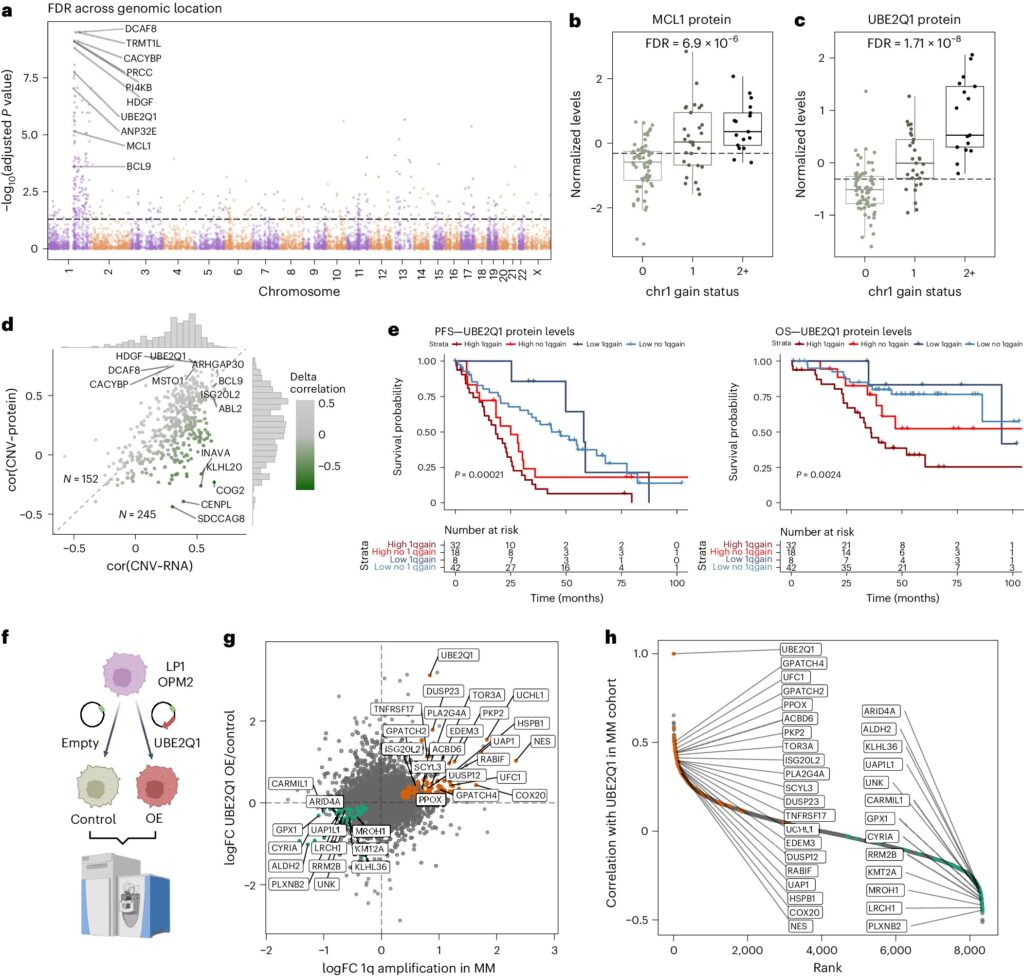
Identification de UBE2Q1 comme protéine candidate pour le phénotype agressif du MM avec gain/amp du chromosome 1q. Crédit : Cancer naturel (2024). DOI : 10.1038/s43018-024-00784-3
Le myélome multiple est l’une des formes les plus courantes de cancer des cellules immunitaires de la moelle osseuse. Il est considéré comme incurable. Même lorsque les patients répondent au traitement dans un premier temps, le cancer réapparaît.
Afin de pouvoir intervenir plus rapidement et de manière plus ciblée, des chercheurs de la Charité-Universitätsmedizin Berlin, de l’Institut de santé de Berlin à la Charité (BIH) et du Centre Max Delbrück se sont associés à d’autres partenaires pour une étude approfondie de cette maladie au niveau moléculaire.
L’équipe décrit désormais comment des types de tumeurs très agressifs peuvent être détectés précocement dans un article publié dans la revue Cancer naturelIls montrent comment les changements dans le matériel génétique affectent le profil protéique des cellules tumorales, et donc les mécanismes impliqués dans la maladie.
Le myélome multiple est une forme de cancer dans laquelle les cellules immunitaires de la moelle osseuse, appelées plasmocytes, mutent et deviennent cancéreuses. Les plasmocytes sont responsables de la production d’anticorps. Tous les êtres humains possèdent de nombreux types de plasmocytes différents qui produisent un grand nombre d’anticorps différents. Cela permet au corps de reconnaître et de combattre divers agents pathogènes.
Dans le myélome multiple, un seul plasmocyte mute en cellule tumorale. Cette cellule se reproduit de manière incontrôlée, formant une population de cellules monoclonales. Cela signifie que de nombreuses cellules se forment, toutes exactement identiques et génétiquement identiques au début. Les cellules mutées produisent souvent également de grandes quantités d’anticorps ou des fragments de ceux-ci, mais elles ne fonctionnent pas correctement.
Au cours de la maladie, la plupart des patients développent des tumeurs à divers endroits de la moelle osseuse, d’où le terme « multiple » dans le nom de la maladie. L’immunodéficience, l’insuffisance rénale, la perte osseuse et les fractures osseuses ne sont que quelques-unes des conséquences de cette croissance cellulaire incontrôlée.
Malgré les progrès thérapeutiques et l’introduction de nouvelles thérapies géniques et cellulaires, il n’existe actuellement aucun remède contre le myélome multiple. C’est avec ce problème à l’esprit qu’une équipe de chercheurs dirigée par Jan Krönke du Département d’hématologie, d’oncologie et d’immunologie du cancer de la Charité et du Dr Philipp Mertins, responsable de la plateforme technologique protéomique du Centre Max Delbrück et de BIH, s’est lancée dans la recherche de nouvelles approches en matière de diagnostic et de traitement.
Quel chemin emprunte la tumeur ?
Il n’existe pas deux cas de cancer identiques, et le myélome multiple ne fait pas exception. Les tumeurs se développent différemment selon les individus, et à des rythmes différents. Il est donc plus difficile de prévoir l’évolution de la maladie et de choisir le traitement optimal. Si les plasmocytes mutés ne se propagent pas beaucoup dans certains cas, ils sont extrêmement agressifs dans d’autres, ce qui entraîne un pronostic sombre.
Mais qu’est-ce qui est à l’origine de tant de divergences dans l’évolution du myélome multiple ? En collaboration avec des experts en analyse de protéines du Centre Max Delbrück et du BIH, les chercheurs ont mené une étude détaillée des modifications génétiques et moléculaires survenant dans les cellules tumorales d’un groupe de plus d’une centaine de patients.
L’étude a porté sur les données des patients du groupe d’étude allemand sur le myélome multiple (DSMM), coordonné par l’hôpital universitaire de Würzburg. Les chercheurs ont ainsi pu inclure des données cliniques sur des patients ayant reçu un traitement standardisé sur une période de huit ans ou plus après le diagnostic initial.
Médecine des systèmes et big data
Alors que les changements dans le génome et leurs effets sur le protéome sont déjà bien décrits pour d’autres types de cancer, il s’agit de la première étude protéogénomique détaillée du myélome multiple.
« Les données génétiques seules ne suffisent pas à expliquer les mécanismes impliqués dans cette maladie », explique le Dr Mertins. « Nous voulions connaître les conséquences des modifications génétiques au niveau des protéines et comparer ces données de biologie moléculaire à l’évolution réelle de la maladie chez les patients. »
L’équipe a été soutenue dans la collecte et l’analyse de grands volumes de données par des experts de la Charité, du BIH et du Consortium allemand contre le cancer (DKTK).
Des méthodes de spectrométrie de masse de pointe ont permis de cartographier le profil protéique des plasmocytes mutés et de le comparer à celui des plasmocytes sains chez des personnes non atteintes de la maladie. Les chercheurs ont découvert que les changements génétiques et les changements dans les voies de signalisation conduisent à une activation incontrôlée des cellules cancéreuses. Les processus de régulation au niveau des protéines ont eu la plus forte influence.
Les chercheurs ont identifié une constellation de protéines qui suggère que la maladie suivra une évolution particulièrement agressive, quels que soient les autres facteurs de risque connus.
Débloquer de nouvelles thérapies
“Nos résultats aideront à sous-catégoriser les patients plus efficacement, en personnalisant leur traitement”, conclut Krönke. “Nous avons identifié des protéines clés et des voies de signalisation qui peuvent servir de base à des traitements encore plus efficaces et mieux tolérés du myélome multiple, par exemple pour des thérapies immunitaires telles que la thérapie cellulaire CAR T.”
Dans les étapes suivantes, les chercheurs prévoient d’étudier lesquelles des structures cibles qu’ils ont identifiées sont en fait de bons candidats pour de nouvelles approches thérapeutiques.
L’étude est une ressource essentielle pour la recherche et le développement appliqué, déclare le Dr Evelyn Ramberger, première auteure de l’étude. Elle ajoute : « Pour rendre cet ensemble de données complexe gérable, nous avons programmé un outil en ligne interactif et disponible gratuitement. »
Cela a permis aux chercheurs en cancérologie d’accéder facilement aux résultats, afin qu’ils puissent utiliser ces informations pour développer de nouveaux traitements et tests afin d’aider à orienter le traitement. Par exemple, il pourrait être possible de traiter dès le départ des patients atteints d’une forme particulièrement agressive de myélome multiple avec des thérapies plus intensives.
Plus d’information:
Evelyn Ramberger et al, Le paysage protéogénomique du myélome multiple révèle des informations sur la biologie de la maladie et les opportunités thérapeutiques, Cancer de la nature (2024). DOI : 10.1038/s43018-024-00784-3
Fourni par Charité – Universitätsmedizin Berlin
Citation: Myélome multiple : nouvelles connaissances sur la détection précoce des tumeurs agressives (1er juillet 2024) récupéré le 1er juillet 2024 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.