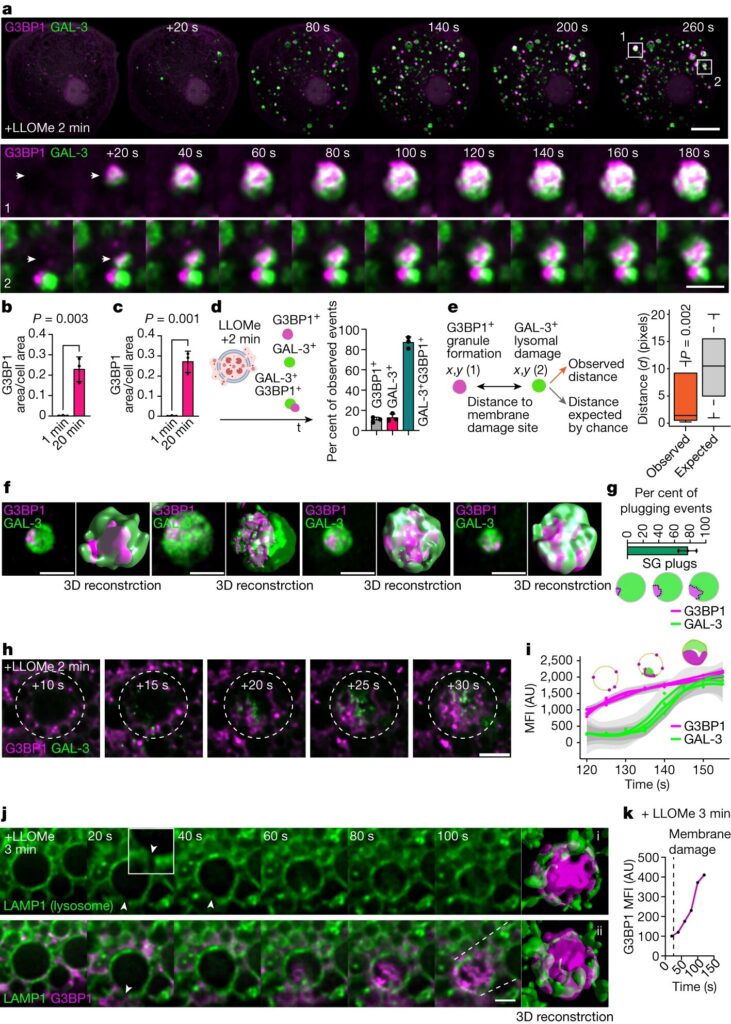
Des granules de stress se forment à proximité des sites de lésions endomembranaires. un, Séquence d’imagerie de cellules vivantes d’iPSDM exprimant G3BP1 – GFP et GAL-3 – RFP après 2 min de traitement LLOMe (1 mM). Les régions décrites dans la rangée supérieure sont agrandies dans les deux rangées inférieures. Les pointes de flèche mettent en évidence la période avant et après la détection d’un événement G3BP1/GAL-3. b,cQuantification de l’aire de G3BP1 (b) et GAL-3 (c) puncta normalisé à la surface cellulaire à partir d’expériences d’imagerie de cellules vivantes comme décrit dans un. n= 30 cellules examinées sur 3 expériences indépendantes ; à deux queues t -test. d, Schéma résumant les différents types d’événements observés dans les 20 premières minutes après l’induction de lésions lysosomales. Le graphique montre le pourcentage de G3BP1 unique+ événements, GAL-3+ événements ou GAL-3 combinés+G3BP1+ événements observés par imagerie de cellules vivantes. eAnalyse de configuration de points spatiaux appliquée à G3BP1+ et GAL-3+ événements. Dans les diagrammes en boîte, la ligne centrale est la médiane, les carrés délimitent l’intervalle interquartile (IQR) et les moustaches représentent la plage de données comprise dans une plage de 1,5 fois l’IQR. n= 40 événements examinés sur 3 expériences indépendantes ; P. valeur par une approche basée sur la simulation de Monte Carlo. F« modèle de prise » polarisé G3BP1 sur GAL-3+ vésicules endommagées et la 3D correspondante z-reconstruction de pile. gQuantification et schéma des événements de branchement présentés dans F. n = 40 événements examinés sur 3 expériences indépendantes. SG, granule de stress. hSéquence d’images (fréquence d’image de 1 s, affichée à intervalles de 5 s) d’iPSDM exprimant G3BP1 – GFP (magenta) et GAL-3 – RFP (vert) après 2 min de traitement LLOMe. jeIntensité moyenne de fluorescence (MFI) au fil du temps de G3BP1+ et GAL-3+ événements comme indiqué dans h. Les graphiques montrent les traces dans le temps et l’erreur standard. n= 30 événements examinés sur 3 expériences indépendantes. AU, unités arbitraires. j, Séquence d’imagerie de cellules vivantes d’iPSDM exprimant LAMP1 – RFP et G3BP1 – GFP. La pointe de flèche indique le site de rupture de la membrane. Le panneau à l’extrême droite montre une reconstruction 3D. kMFI de G3BP1 – GFP au fil du temps pour la séquence présentée dans j. Les graphiques à barres indiquent la moyenne ± sem d’au moins trois expériences indépendantes. Barres d’échelle : 10 μm (unen haut), 2 μm (unmilieu, bas, F,h,j). Crédit: Nature(2023). DOI : 10.1038/s41586-023-06726-w
Des chercheurs du Francis Crick Institute ont découvert que des structures cellulaires appelées granules de stress remplissent une fonction protectrice essentielle en soutenant la réponse immunitaire contre des infections comme la tuberculose (TB).
Ces connaissances biologiques pourraient également aider les chercheurs à comprendre le rôle d’organites similaires dans la protection contre les maladies qui provoquent également des dommages cellulaires, notamment le cancer et la neurodégénérescence.
Lors d’une infection par Mycobacterium tuberculosis, des cellules immunitaires appelées macrophages sont recrutées pour envelopper la bactérie et éliminer la menace. Mais les bactéries peuvent sécréter des produits chimiques pour endommager la membrane des macrophages et échapper à leur « prison immunitaire ».
Les résultats de l’équipe, publiés aujourd’hui dans Naturemontrent que lorsque les membranes des macrophages sont rompues, les granules de stress forment rapidement une plaque pour boucher les interstices, permettant ainsi à la machinerie de réparation cellulaire de venir réparer les dommages.
L’équipe a également montré que la capacité à recruter ces « emplâtres moléculaires » était essentielle pour maintenir l’infection sous contrôle. Lorsqu’ils ont modifié les cellules infectées pour éliminer les gènes responsables de la formation des granules de stress, les macrophages ne pouvaient plus envelopper et détruire les bactéries, permettant ainsi à l’infection de prendre le dessus.
Ce colmatage observé dans les macrophages a été confirmé à l’aide de vésicules artificielles formées in vitro en collaboration avec Agustin Mangiarotti au laboratoire de Rumiana Dimova à l’Institut Max Planck des colloïdes et interfaces, Potsdam, Allemagne.
En collaboration avec Christian Vanhille-Campos du groupe dirigé par Anđela Šarić à l’Institut des sciences et technologies de Vienne, en Autriche, ils ont également validé leurs résultats de laboratoire avec des modèles informatiques de dommages et de réparation des organites, qui ont montré des schémas similaires de formation de plaques. sur les zones endommagées.
Claudio Bussi, chercheur postdoctoral au Crick et premier auteur et co-sénior de l’étude, a déclaré : « La résistance aux antibiotiques présente une menace très réelle pour le contrôle des infections comme la tuberculose, il est donc essentiel que nous comprenions comment le corps réagit au défi. d’infection.
“Non seulement nous avons découvert un nouveau rôle protecteur des granules de stress, mais nous avons également démontré à quel point ils sont essentiels pour soutenir la réponse immunitaire contre la tuberculose.”
L’équipe prévoit de continuer à étudier le rôle des granules de stress et éventuellement d’autres molécules similaires afin de trouver des moyens de renforcer les défenses naturelles contre les infections.
Max Gutierrez, chef du laboratoire des interactions hôte-pathogène dans la tuberculose qui a supervisé l’étude au Crick, a déclaré : « Il existe un certain nombre de molécules sans membrane différentes, comme les granules de stress, dont beaucoup ont des fonctions inconnues. comme des pansements ou des échafaudages, aidant à protéger l’intégrité des cellules qui subissent des blessures.
“Cela n’est pas seulement important en cas d’infection, mais aussi dans d’autres maladies où des dommages aux cellules et aux organites peuvent survenir, comme le cancer et les maladies neurodégénératives comme la maladie de Parkinson.”
Plus d’information:
Claudio Bussi et al, Les granules de stress bouchent et stabilisent les membranes endolysosomales endommagées, Nature(2023). DOI : 10.1038/s41586-023-06726-w
Fourni par l’Institut Francis Crick
Citation: Des chercheurs découvrent le rôle des « emplâtres moléculaires » qui protègent contre les infections (21 novembre 2023) récupéré le 21 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.