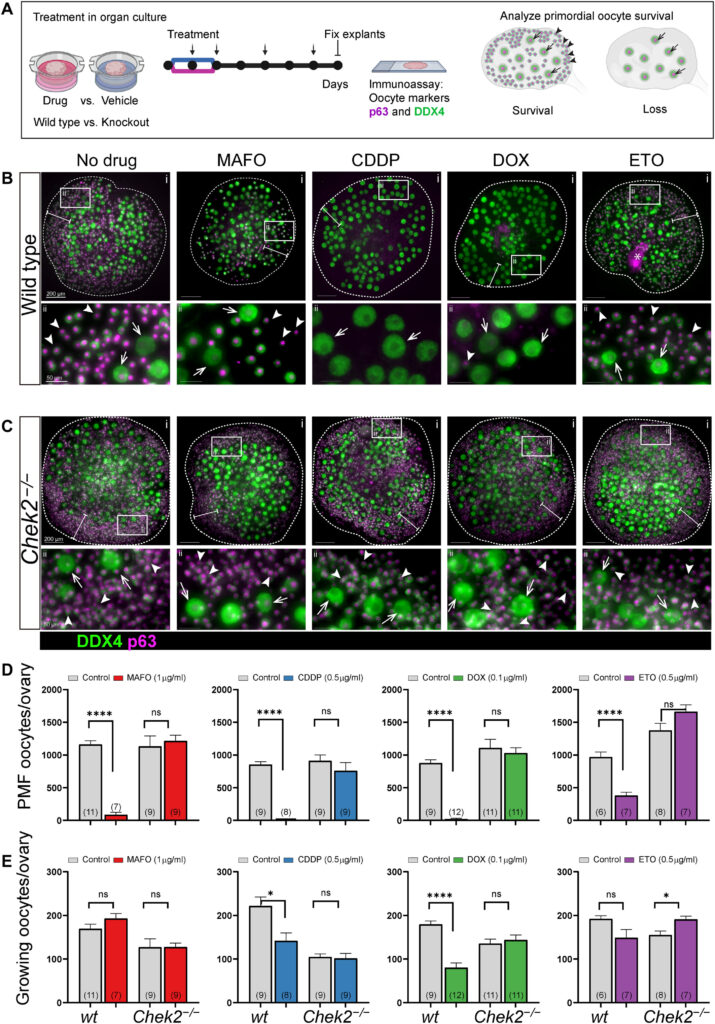
Le déficit en CHEK2 empêche la déplétion des ovocytes primordiaux après un traitement ex vivo avec MAFO, CDDP, DOX et ETO. Crédit: Avancées scientifiques (2023). DOI : 10.1126/sciadv.adg0898
Le traitement du cancer peut priver les femmes en âge de procréer de leur fertilité, mais de nouvelles recherches ont révélé comment la protéine traîtresse du corps conspire avec la chimiothérapie et d’autres thérapies sévères contre les follicules primordiaux des ovaires, qui abritent les ovocytes immatures – la totalité de la réserve d’ovules ovariens.
Une protéine nocive pour la fertilité appelée CHEK2, lorsqu’elle est déclenchée par la destruction de l’ADN par la chimiothérapie, est à elle seule responsable de la suppression coordonnée des follicules primordiaux contenant des ovules immatures, les ovocytes, selon un petit groupe de recherche du laboratoire Jackson dans le Maine. Mais dans une découverte étonnante, bien que sur des modèles murins menés dans le cadre de la recherche, l’équipe a découvert que le blocage de CHEK2 avec un inhibiteur arrête l’activité de destruction des follicules de la protéine, préservant ainsi la réserve vitale d’ovules et la fertilité.
Les scientifiques du Jackson Lab affirment que CHEK2 est une cible attrayante pour les futures interventions de préservation de la fertilité qui garantissent la santé reproductive et la probabilité d’une grossesse réussie pour les femmes survivantes du cancer. Lorsque CHEK2 est déficient, affirment ces scientifiques, les ovocytes peuvent survivre à la chimiothérapie.
“Les femmes naissent avec une quantité limitée de follicules primordiaux qui constituent la réserve ovarienne”, écrit Chihiro Emori, auteur principal d’une nouvelle étude publiée dans la revue Avancées scientifiques.
“La suffisance hormonale et la santé optimale des femmes dépendent d’un apport important de follicules dans l’ovaire. En effet, les follicules en développement sont une source majeure d’hormones féminines, telles que les œstrogènes, responsables du développement et de la régulation du système reproducteur féminin et de l’ensemble de la reproduction. santé.”
La cryoconservation des ovules est le moyen par lequel de nombreuses femmes en âge de procréer conservent l’espoir d’avoir des enfants des années après un traitement anticancéreux suivi d’une fécondation in vitro, qui peut ou non réussir. La nouvelle recherche ouvre la voie à la préservation totale de la fertilité. À l’aide de modèles de souris, les chercheurs du Jackson Lab ont maintenant défini pourquoi la fertilité est perdue et proposent l’inhibition de CHEK2 comme moyen de préserver un approvisionnement solide en œufs.
Emori est chercheur postdoctoral dans le laboratoire du Dr Ewelina Bolcun-Filas, qui a participé à cette étude, et est depuis longtemps un champion de la recherche sur la préservation de la fertilité. Emori et Bolcun-Filas ont été aidés dans la nouvelle analyse par le chercheur Zachary Boucher. L’équipe a examiné les mécanismes sous-jacents à la perte de fertilité due au traitement du cancer, et leur dernière étude met en lumière une protéine autrefois obscure dont le nom complet est Checkpoint kinase 2, mais qui est plus fréquemment identifiée par son surnom abrégé, CHEK2.
CHEK2 a un cousin germain appelé CHEK1, qui est activé pendant le traitement du cancer lorsque la double hélice de l’ADN est endommagée et subit une cassure simple brin dans l’hélice. La réparation de l’ADN est possible après une cassure simple brin. CHEK2 est activé dans les cassures hélicoïdales double brin, le type de dommage à l’ADN le plus mortel, expliquent les scientifiques du Jackson Lab dans leurs recherches.
Une fois activé, CHEK2 déclenche deux cibles en aval, Tap63 et p53, qui dirigent l’élimination des ovocytes. L’équipe a en outre découvert que TAp63 et p53 peuvent également être déclenchés par une classe de médicaments de chimiothérapie appelés agents alkylants, qui contribuent aux dommages à l’ADN et à l’élimination des ovocytes. En tant que médicaments contre le cancer, les agents alkylants empêchent la réplication de l’ADN et freinent la croissance des cellules cancéreuses, mais accélèrent les problèmes liés à la santé ovarienne en exacerbant les dommages folliculaires primordiaux, et donc la perte de fertilité.
“Les traitements génotoxiques contre le cancer tuent les cellules cancéreuses en induisant des dommages à l’ADN sous la forme de cassures simple brin et double brin, qui sont plus préjudiciables aux cellules cancéreuses à division rapide qu’aux cellules saines. Cependant, ces traitements peuvent également endommager les cellules saines, notamment les ovocytes. “, selon Emori et ses collègues. “Les dommages à l’ADN infligés aux ovocytes primaires résidant dans les follicules primordiaux sont le principal déclencheur de l’élimination des follicules primordiaux induite par la radiothérapie et la chimiothérapie.”
Lorsque les femmes en âge de procréer subissent un traitement contre le cancer et perdent des follicules primordiaux à la suite de ce traitement, leurs ovaires cessent de produire des hormones féminines vitales, ce qui déclenche une ménopause prématurée. Une fois ménopausée, le risque augmente de maladie cardiaque, d’accident vasculaire cérébral et de déclin cognitif.
“La façon dont différents médicaments de chimiothérapie infligent des dommages aux ovaires et aux ovocytes méiotiquement arrêtés en particulier, et comment ces dommages déclenchent l’élimination des ovocytes primordiaux, n’est pas encore entièrement comprise”, rapportent Emori et ses collègues.
“Les médicaments de chimiothérapie peuvent endommager l’ADN directement et indirectement en augmentant le stress oxydatif”, ajoutent les chercheurs, notant “qu’il est possible que ces médicaments induisent des dommages indirects à l’ADN dans les ovocytes en raison d’une augmentation des espèces réactives de l’oxygène qui s’accumulent au fil du temps”. Il a été démontré que des médicaments réduisant le stress oxydatif diminuent leur ovotoxicité.
Alors qu’une partie de la recherche expliquait à quel point les dommages délétères aux ovocytes provoqués par l’activation de CHEK2 pouvaient être, Emori et ses collègues ont fait un pas en avant majeur dans la recherche et ont posé cette question alléchante : et si CHEK2 était inhibée ? Pour le savoir, ils se sont tournés vers un médicament expérimental appelé AZD7762.
“AZD7762 a bloqué l’activation de CHEK2 pendant le traitement médicamenteux et amélioré la survie des ovocytes. Cela suggère que l’inhibition de la voie CHEK2 a entraîné une réparation suffisante de l’ADN pour échapper à l’apoptose même après le retrait de l’inhibiteur”, affirment les chercheurs.
“Les preuves de travaux antérieurs et d’autres études indiquent que les ovocytes primordiaux qui survivent aux agressions génotoxiques soutiennent effectivement la fonction ovarienne et la fertilité normales. De plus, l’inactivation génétique de CHEK2 protège presque complètement les ovocytes primordiaux”, conclut l’équipe.
Plus d’information:
Chihiro Emori et al, la signalisation CHEK2 est le régulateur clé de la survie des ovocytes après chimiothérapie, Avancées scientifiques (2023). DOI : 10.1126/sciadv.adg0898
© 2023 Réseau Science X
Citation: La fertilité féminine peut-elle survivre à un traitement anticancéreux sévère ? Les scientifiques qui se sont tournés vers des modèles animaux disent que la réponse est « oui » (31 octobre 2023) récupéré le 31 octobre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.