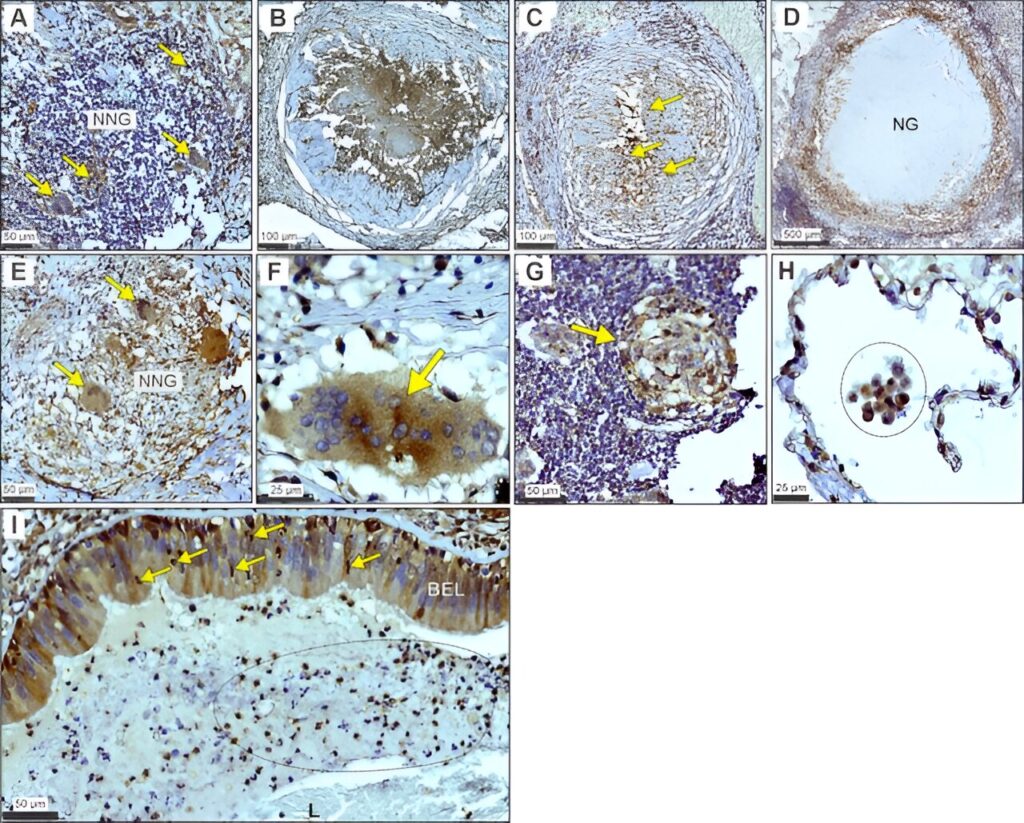
Immunocoloration LDHA sur tout le spectre histopathologique de la tuberculose humaine. Une coloration focale de LDHA (flèches jaunes) au sein d’un granulome non nécrotique (NNG). B Coloration homogène de la LDHA au sein du centre nécrotique d’un granulome nécrotique précoce. C Coloration hétérogène de LDHA au sein du centre nécrotique d’une lésion nécrotique plus développée. Les flèches jaunes indiquent les noyaux pycnotiques au sein du centre nécrotique. D Coloration du LDHA dans la couche de granulation et la région inflammatoire granulomateuse environnante d’un granulome nécrotique (NG). E Images à grossissement moyen et (F) élevé de cellules géantes immunocolorées pour LDHA (flèches jaunes) dans le contexte de (E) un granulome non nécrosant (NNG) et (F) un granulome nécrosant. Coloration G LDHA d’un agrégat lymphoïde (flèche jaune) dans une région proximale à un NG. H Image à fort grossissement de la coloration LDHA dans les leucocytes (région encerclée) dans une alvéole d’un patient tuberculeux humain. I Coloration LDHA des neutrophiles (flèches jaunes) traversant la couche épithéliale bronchique (BEL) positivement colorée dans le contexte de débris inflammatoires et nécrotiques (région ovale marquée) dans la lumière des voies respiratoires (L). La coloration des tissus et les contrôles de coloration obtenus chez trois patients tuberculeux ont été effectués au moins trois fois indépendamment après l’optimisation. Crédit: Communications naturelles (2023). DOI : 10.1038/s41467-023-40545-x
On ne sait pas exactement comment Mycobacterium tuberculosis dévie la réponse immunitaire chez l’homme, bien que des preuves aient mis en évidence l’immunométabolisme de l’hôte, le lien intrinsèque entre le métabolisme des cellules immunitaires et leur fonction immunitaire. On sait que l’agent pathogène M. tuberculosis perturbe une voie métabolique appelée glycolyse dans les cellules myéloïdes infectées, qui comprennent les macrophages, par un mécanisme peu clair.
Une compréhension plus précise de ce mécanisme pathogène pourrait fournir une cible contre la bactérie qui a causé 1,6 million de décès en 2021, ainsi que 10 millions de nouveaux cas de tuberculose chaque année.
Maintenant, une étude publiée dans Communications naturelles par des chercheurs de l’Université d’Alabama à Birmingham et de l’Institut de recherche en santé en Afrique (AHRI), montre comment M. tuberculosis perturbe l’homéostasie de la molécule à haute énergie NADH et reprogramme la glycolyse dans les cellules myéloïdes. Cela met en évidence la glycolyse comme cible thérapeutique potentielle pour lutter contre la principale maladie infectieuse mortelle au monde.
La glycolyse est la voie qui convertit le glucose en pyruvate tout en formant les molécules à haute énergie ATP et NADH. Mais la voie peut aller dans les deux sens, et les chercheurs en ont profité pour appliquer une approche plus sélective pour inhiber le flux glycolytique. Des expériences antérieures ont adopté une approche plus semblable à celle d’un marteau, comme l’utilisation d’un inhibiteur qui bloque l’absorption du glucose dans les cellules myéloïdes.
Le processus réversible de fermentation du lactate est catalysé par l’enzyme lactate déshydrogénase, ou LDH. La LDH comporte quatre sous-unités, un mélange de sous-unités LDHA et LDHB. Lorsque la LDH est constituée majoritairement de sous-unités LDHA, sous-unité majoritairement exprimée dans les cellules myéloïdes, elle convertit préférentiellement le pyruvate en lactate et le NADH en NAD.+. Cependant, une LDH composée de sous-unités LDHB favorise la réaction inverse.
Le rôle du LHDA dans la pathogenèse de la tuberculose est inconnu. Les chercheurs de l’UAB et de l’AHRI ont examiné les tissus pulmonaires réséqués de patients atteints de tuberculose et ont découvert que les cellules myéloïdes, épithéliales bronchiques et les lymphocytes étaient positifs pour la LDHA alors qu’ils se livraient à des phénomènes immunologiques distinctifs tels que la formation de granulomes et l’alvéolite. “Ces données impliquent la LDHA en tant que protéine métabolique importante dans la réponse immunitaire dans les lésions tuberculeuses humaines”, a déclaré Adrie Steyn, Ph.D., auteur principal de la recherche.
Sachant que NADH/NAD+ régule la glycolyse à des étapes définies, Steyn et ses collègues ont émis l’hypothèse que le flux glycolytique médié par le NAD(H) dans les cellules myéloïdes protège l’hôte contre l’infection par M. tuberculosis. Pour tester cela, ils ont créé des souris dépourvues de la sous-unité LDHA dans les cellules myéloïdes. Ces cellules ont une capacité glycolytique réduite car la fonction altérée de la LDH, composée uniquement de sous-unités LDHB, diminue leur capacité à régénérer le NAD.+ du NADH en présence de pyruvate.
Les souris déficientes en LDHA, infectées par une faible dose de M. tuberculosis, étaient plus sensibles à l’infection et avaient une durée de survie considérablement réduite. En outre, la pathologie globale et l’histopathologie des poumons étaient pires chez les souris déficientes en LDHA. De plus, les souris de type sauvage développent initialement une réponse inflammatoire robuste contre l’infection par M. tuberculosis en tant que réponse immunitaire protectrice, tandis que les souris déficientes en LDHA présentaient une absence frappante d’inflammation précoce.
“Cela suggère que le LDHA est nécessaire à la protection contre la tuberculose et que le flux glycolytique dans les cellules myéloïdes est essentiel pour le contrôle de l’infection et de la maladie à M. tuberculosis”, a déclaré Steyn.
Malgré les preuves d’une réponse immunitaire réduite, lorsque les chercheurs ont quantifié l’expression des gènes dans les poumons des souris déficientes en LDHA, ils ont découvert que les ARNm associés aux processus inflammatoires étaient parmi les plus enrichis, en particulier un ensemble de gènes robustes d’interféron gamma.
“La signature robuste de l’expression du gène de l’interféron gamma chez des souris plus sensibles avec une réponse immunitaire atténuée était particulièrement intrigante puisque l’interféron gamma est une cytokine antimycobactérienne indispensable largement considérée comme protectrice contre la tuberculose”, a déclaré Steyn.
Cette énigme a été résolue grâce à des expériences bioénergétiques qui ont montré que les macrophages de souris ont besoin de LDHA et de son NAD médié par la LDH.+ régénération pour leur réponse métabolique à l’interféron gamma.
Depuis NAD+ l’épuisement semblait être au cœur de l’inhibition glycolytique provoquée par M. tuberculosis, les chercheurs ont demandé si l’ajout d’un NAD+ le précurseur, le nicotinamide, altérerait la capacité des macrophages à déclencher une réponse immunitaire.
Il a été constaté que le nicotinamide augmente la capacité glycolytique des macrophages dérivés de la moelle osseuse infectés par M. tuberculosis. Les chercheurs ont émis l’hypothèse que le nicotinamide agit comme une thérapie dirigée par l’hôte en améliorant la glycolyse dans les macrophages infectés par M. tuberculosis grâce à sa conversion en NAD(H) via le NAD.+ voie de sauvetage.
Ils ont découvert que le nicotinamide était un traitement efficace contre la tuberculose dans des expériences in vitro au cours desquelles ils ont infecté des macrophages avec M. tuberculosis exprimant la luciférase. Les macrophages infectés ont montré que le nicotinamide réduisait la luminescence 48 heures après l’infection en fonction de la dose, et cette réduction des bactéries pathogènes dépendait de la glycolyse. Dans un modèle murin, nourrir les souris avec du nicotinamide pendant quatre semaines, soit trois jours soit 28 jours après l’infection, a montré une réduction par dix de la charge de M. tuberculosis dans les poumons, ainsi qu’une réduction de l’inflammation dans les poumons.
La nicotinamide a été décrite pour la première fois comme traitement contre la tuberculose dans les années 1940, via un mécanisme différent ; mais il a été largement abandonné lorsque des médicaments beaucoup plus efficaces ont été découverts à l’âge d’or des antibiotiques.
Cependant, le paysage de la tuberculose a radicalement changé au cours des 60 dernières années. L’incidence de la tuberculose a augmenté pour atteindre plus de 10 millions de nouveaux cas par an, et l’agent pathogène a développé une résistance aux médicaments de première ligne qui ont remplacé le nicotinamide, explique Steyn.
“Nous avons fourni des preuves supplémentaires d’un effet dépendant de l’hôte du nicotinamide, des exigences métaboliques de son activité et une démonstration moderne de son efficacité en tant que traitement de la tuberculose, en utilisant deux schémas thérapeutiques in vivo”, a déclaré Steyn à propos de l’étude actuelle. .
“Sur le plan logistique, le nicotinamide satisfait à de nombreux critères d’un nouveau schéma thérapeutique optimal contre la tuberculose, établis par l’Organisation mondiale de la santé. Il est peu coûteux, biodisponible par voie orale, stable à la conservation, remarquablement sûr et tolérable, et il est bien étudié et couramment utilisé dans ”
Une question sans réponse demeure, dit Steyn. Comment M. tuberculosis épuise-t-il les niveaux de NAD(H) ? Selon les chercheurs, une explication partielle pourrait être la sécrétion par M. tuberculosis de la toxine nécrosante de la tuberculose, ou TNT, un NAD.+ glycohydrolase. Cette toxine, rapportée par Michael Niederweis, Ph.D. de l’UAB, en 2015, est la première toxine jamais trouvée dans M. tuberculosis au cours de 132 années d’étude. Le TNT dans M. tuberculosis de type sauvage réduit considérablement le NAD+ abondance dans les macrophages infectés.
Steyn est professeur de microbiologie à l’UAB et supervise les laboratoires de l’UAB et de l’AHRI, à Durban, dans le KwaZulu Natal, en Afrique du Sud, une région qui est l’épicentre mondial des infections tuberculeuses. Niederweis est professeur au département de microbiologie de l’UAB.
Le premier auteur de la nouvelle étude, « L’homéostasie NAD(H) sous-tend la protection de l’hôte médiée par les cellules myéloïdes glycolytiques dans la tuberculose », est Hayden T. Pacl, MD, Ph.D., Département de microbiologie de l’UAB.
Les co-auteurs avec Steyn et Pacl sont Krishna C. Chinta, Vineel P. Reddy, Sajid Nadeem, Ritesh R. Sevalkar et Joel N. Glasgow, Département de microbiologie de l’UAB ; Anupam Agarwal, Département de médecine de l’UAB, Division de néphrologie ; et Kievershen Nargan, Kapongo Lumamba et Threnesan Naidoo, AHRI, Université du KwaZulu Natal, Durban, Afrique du Sud. Naidoo a également un rendez-vous à l’Université Walter Sisulu, Eastern Cape, Afrique du Sud.
Plus d’information:
Hayden T. Pacl et al, L’homéostasie du NAD(H) est à la base de la protection de l’hôte médiée par les cellules myéloïdes glycolytiques dans la tuberculose, Communications naturelles (2023). DOI : 10.1038/s41467-023-40545-x
Fourni par l’Université de l’Alabama à Birmingham
Citation: Une recherche met en évidence la perturbation de l’homéostasie du NAD(H) comme cible thérapeutique potentielle pour lutter contre la tuberculose (20 novembre 2023) récupéré le 20 novembre 2023 de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.