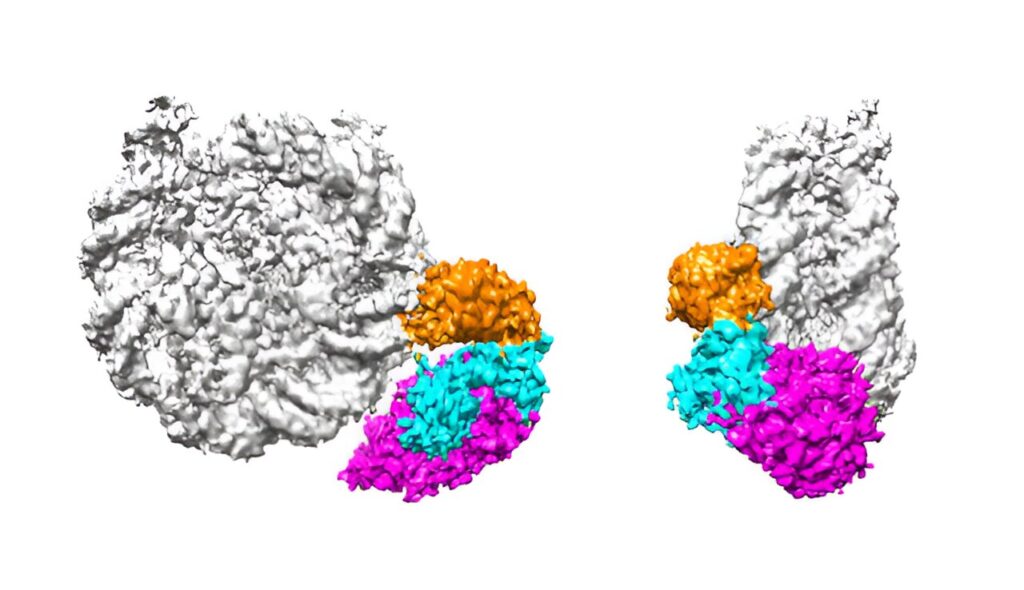
Deux vues de la façon dont p300/CBP (coloré) propage l’acétylation des histones dans le complexe nucléosomique (gris). Le domaine « lecture » orange reconnaît et se lie aux acétylations sur H3-H4, tandis que le domaine « écriture » magenta transcrit les acétylations de H3-H4 vers H2B-H2A. Crédit : Centre RIKEN pour la recherche sur la dynamique des biosystèmes
Le mécanisme « lecture-écriture » par lequel les cellules se répliquent et utilisent des instructions chimiques pour exprimer des gènes a été découvert par les chercheurs de RIKEN. La qualité et la quantité de l’expression des gènes sont en corrélation non seulement avec les instructions des facteurs de transcription, mais également avec les modifications chimiques apportées aux diverses protéines histones, qui fournissent un échafaudage à l’ADN dans les chromosomes.
Les scientifiques se demandent depuis longtemps si ces modifications des histones sont la cause épigénétique de l’activation de l’expression des gènes. Et, si tel est le cas, comment ils activent l’expression des gènes et se maintiennent pendant le processus de mitose, au cours duquel une cellule se divise en deux cellules filles.
“La question de savoir si les modifications des histones sont la cause épigénétique de l’expression des gènes est restée une hypothèse car personne n’avait jamais vu si les modifications des histones s’auto-répliquaient”, explique Takashi Umehara du Centre RIKEN pour la recherche sur la dynamique des biosystèmes.
Pour explorer cette question, Umehara et son équipe se sont concentrés sur une protéine connue sous le nom de p300/CBP, une enzyme qui peut à la fois introduire et se lier aux modifications du groupe acétyle (acétylations) sur les protéines histones. Plus précisément, les chercheurs se sont intéressés aux acétylations spécifiques du complexe histone H3-H4 auquel se lie p300/CBP. Ces acétylations sont connues pour activer l’expression des gènes dans les séquences d’ADN voisines.
Mais H3-H4 n’est qu’un composant d’un ensemble plus vaste de « nucléosomes », qui comprend également le complexe histone H2B-H2A. Toutes ces différentes histones peuvent porter des modèles d’acétylation distincts, et les relations causales entre leurs acétylations n’ont pas été bien comprises.
Aujourd’hui, Umehara et ses collègues ont développé une technologie expérimentale qui leur a permis de générer des histones avec des acétylations sur des sites définis. Ils ont ensuite surveillé comment p300/CBP interagit avec et acétyle un nucléosome contenant ces histones humaines sélectivement acétylées. L’ouvrage est publié dans la revue Communications naturelles.
L’équipe a découvert que p300/CBP reconnaît et se lie à des marques d’acétylation spécifiques sur le complexe H3-H4. L’enzyme réplique ensuite les marques d’acétylation sur les sites non acétylés de H3 – H4, tout en les transcrivant également de H3 – H4 en H2B – H2A au sein du même nucléosome. Étant donné que ce complexe H2B – H2A nouvellement acétylé est plus susceptible d’être retiré du nucléosome, un modèle apparaît dans lequel il indique finalement quels gènes doivent être transcrits par la machinerie de transcription cellulaire.
Ces résultats fournissent un aperçu sans précédent de la manière dont p300/CBP hérite des marques d’acétylation des cellules nouvellement divisées et utilise ces marques de manière épigénétique pour l’expression des gènes. “Je n’aurais jamais pu imaginer un mécanisme yin-yang aussi élégant pour l’héritage et l’expression de l’information épigénétique”, explique Umehara.
L’équipe d’Umehara vise maintenant à explorer dans quelle mesure ces processus sont conservés chez les espèces non animales, notamment les levures et les plantes.
Plus d’information:
Masaki Kikuchi et al, Mécanismes épigénétiques pour propager l’acétylation des histones par p300/CBP, Communications naturelles (2023). DOI : 10.1038/s41467-023-39735-4
Citation: Le mécanisme de « lecture-écriture » de la cellule : des chercheurs découvrent comment les instructions pour l’expression des gènes sont relayées (7 novembre 2023) récupéré le 7 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.