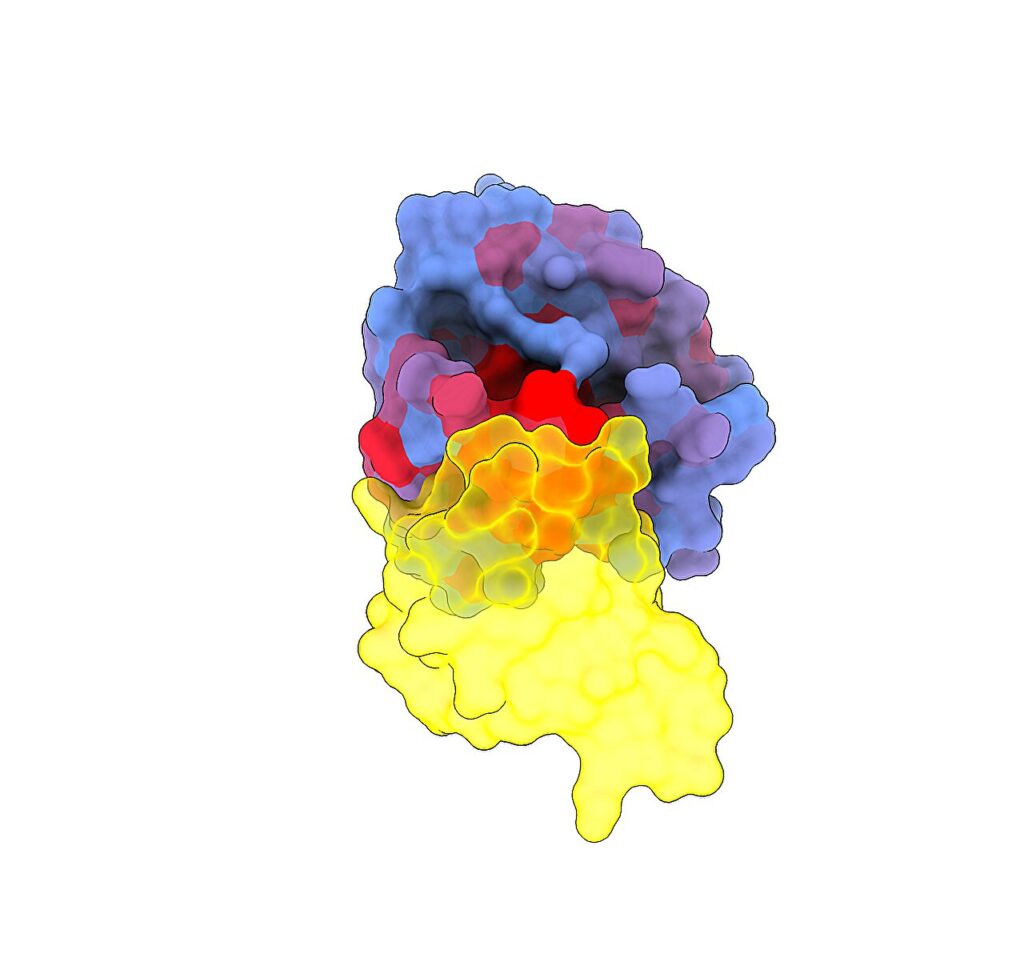
Une image tridimensionnelle montrant la protéine humaine KRAS (bleu) en interaction avec RAF1 (jaune), l'un de ses principaux partenaires. Le dégradé de couleur bleu à rouge indique un potentiel croissant d’effets allostériques. Crédit : Weng, Faure et Escobedo/Centro de Regulación Genómica
Des chercheurs du Centre de régulation génomique de Barcelone, en Espagne, et du Wellcome Sanger Institute près de Cambridge, au Royaume-Uni, ont identifié de manière exhaustive les sites de contrôle allostériques trouvés dans la protéine KRAS. Il s’agit de cibles très recherchées pour le développement de médicaments, représentant des vulnérabilités secrètes qui peuvent être exploitées pour contrôler les effets de l’une des causes les plus importantes de cancer. L'étude présente la première carte de contrôle complète pour n'importe quelle protéine et est publiée dans la revue Nature.
KRAS est l’un des gènes les plus fréquemment mutés dans de nombreux types de cancers. On le retrouve dans un cancer humain sur dix, avec une prévalence plus élevée dans les types mortels tels que les cancers du pancréas ou du poumon. On l'appelle la protéine « Étoile de la mort » en raison de sa forme sphérique et de l'absence d'un bon site à cibler avec des médicaments. Pour cette raison, KRAS a été historiquement considéré comme « non médicamenteux » depuis sa première découverte en 1982.
La seule stratégie efficace pour contrôler KRAS a consisté à cibler son système de communication allostérique. Ce sont des signaux moléculaires qui fonctionnent via un mécanisme de verrouillage et de clé télécommandé. Pour contrôler une protéine, vous avez besoin d’une clé (un composé chimique ou un médicament) capable d’ouvrir une serrure (site actif). Les protéines peuvent également être influencées par un verrou secondaire (site allostérique) situé ailleurs à leur surface.
Lorsqu'une molécule se lie à un site allostérique, elle provoque une modification de la forme de la protéine, qui peut altérer l'activité de la protéine ou sa capacité à se lier à d'autres molécules, par exemple en modifiant la structure interne de son verrou principal.
Les sites allostériques sont souvent préférés pour le développement de médicaments car ils offrent une plus grande spécificité, réduisant ainsi le risque d’effets secondaires. Ils peuvent également modifier l’activité d’une protéine de manière plus subtile, offrant ainsi la possibilité d’affiner sa fonction. Les médicaments ciblant les sites allostériques sont généralement plus sûrs et plus efficaces que les médicaments ciblant les sites actifs.
Cependant, les sites allostériques sont très insaisissables. Malgré quatre décennies de recherche, des dizaines de milliers de publications scientifiques et plus de trois cents structures publiées du KRAS, seuls deux médicaments ont été approuvés pour un usage clinique : le sotorasib et l'adagrasib. Les médicaments agissent en se fixant à une poche adjacente au site actif, induisant un changement conformationnel allostérique de la protéine qui l'empêche d'être activée.
“Il a fallu des décennies pour produire un médicament efficace contre KRAS, en partie parce que nous manquions d'outils pour identifier les sites allostériques à grande échelle, ce qui signifie que nous recherchions des sites cibles thérapeutiques dans l'obscurité. Dans cette étude, nous démontrons une nouvelle approche qui peut cartographier systématiquement les sites allostériques pour protéines entières. Aux fins de la découverte de médicaments, c'est comme allumer les lumières et mettre à nu les nombreuses façons dont nous pouvons contrôler une protéine », explique le Dr André Faure, chercheur au Centre de régulation génomique et co-auteur de l'étude. .
Quatre cibles prometteuses pour des médicaments plus sûrs et plus efficaces
Les auteurs de l'étude ont cartographié les sites allostériques en utilisant une technique appelée analyse mutationnelle profonde. Il s’agissait de créer plus de 26 000 variations de la protéine KRAS, en modifiant seulement un ou deux éléments constitutifs (acides aminés) à la fois. L’équipe a vérifié comment ces différentes variations de KRAS se lient à six autres protéines, y compris celles essentielles au déclenchement du cancer par KRAS. Les chercheurs ont utilisé un logiciel d’IA pour analyser les données, détecter l’allostérie et identifier l’emplacement des sites cibles thérapeutiques connus et nouveaux.
“L'argument de vente unique de notre méthode est son évolutivité. Dans ce seul travail, nous avons effectué plus de 22 000 mesures biophysiques, soit un nombre similaire au total jamais réalisé pour toutes les protéines avant de commencer à exploiter les progrès remarquables des méthodologies de séquençage et de synthèse de l'ADN. est une énorme accélération et démontre la puissance et le potentiel de l'approche”, explique Chenchun Weng, premier auteur de l'étude et chercheur postdoctoral au Centre de régulation génomique.
La technique a révélé que KRAS possède beaucoup plus de sites allostériques forts que prévu. Les mutations dans ces sites ont inhibé la liaison de la protéine à ses trois principaux partenaires, ce qui suggère qu'une inhibition large de l'activité de KRAS est possible. Un sous-ensemble de ces sites est particulièrement intéressant car ils sont situés dans quatre poches différentes facilement accessibles à la surface de la protéine et représentent des cibles prometteuses pour de futurs médicaments.
Les auteurs de l'étude en soulignent une en particulier, la « poche 3 », comme étant particulièrement intéressante. Cette poche est située loin du site actif de KRAS et a donc reçu très peu d’attention de la part des sociétés pharmaceutiques.
Les chercheurs ont également découvert que de petites modifications de KRAS peuvent radicalement modifier son comportement avec ses partenaires, rendant les protéines préférées les unes aux autres. Cela a des implications importantes car cela pourrait conduire à de nouvelles stratégies permettant de contrôler l’activité aberrante du KRAS sans entraver son fonctionnement normal dans les tissus non cancéreux.
Épargner les versions normales de KRAS signifie moins d’effets secondaires et des traitements plus sûrs et plus efficaces. Les chercheurs pourraient également utiliser ces connaissances pour approfondir la biologie du KRAS et expliquer comment la protéine se comporte dans divers scénarios, ce qui pourrait être essentiel pour déterminer son rôle dans différents types de cancer.
Un nouveau plan pour droguer les « indomptables »
L'étude fournit la toute première carte complète des sites allostériques pour n'importe quelle protéine complète dans n'importe quelle espèce. La recherche montre qu'avec les bons outils et techniques, comme ceux utilisés pour cartographier KRAS, de nouvelles vulnérabilités peuvent être découvertes pour de nombreuses protéines médicalement importantes qui ont été historiquement considérées comme « non médicamenteuses ».
“Le grand défi en médecine n'est pas de savoir quelles protéines sont à l'origine des maladies, mais de savoir comment les contrôler. Notre étude représente une nouvelle stratégie pour cibler ces protéines et accélérer le développement de médicaments pour contrôler leur activité. La nature du ciblage des protéines allostériques sites signifie que les médicaments résultants seront probablement des traitements plus sûrs et plus efficaces que ceux dont nous disposons actuellement », conclut le professeur de recherche ICREA, le Dr Ben Lehner, auteur principal de l'étude du Center for Genomic Regulator et du Wellcome Sanger Institute.
Plus d'information:
Le paysage énergétique et allostérique pour l'inhibition de KRAS, Nature (2023). DOI : 10.1038/s41586-023-06954-0
Fourni par le Centre de régulation génomique
Citation: Les vulnérabilités secrètes de la protéine « Death Star » du cancer révélées (18 décembre 2023) récupérées le 18 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.