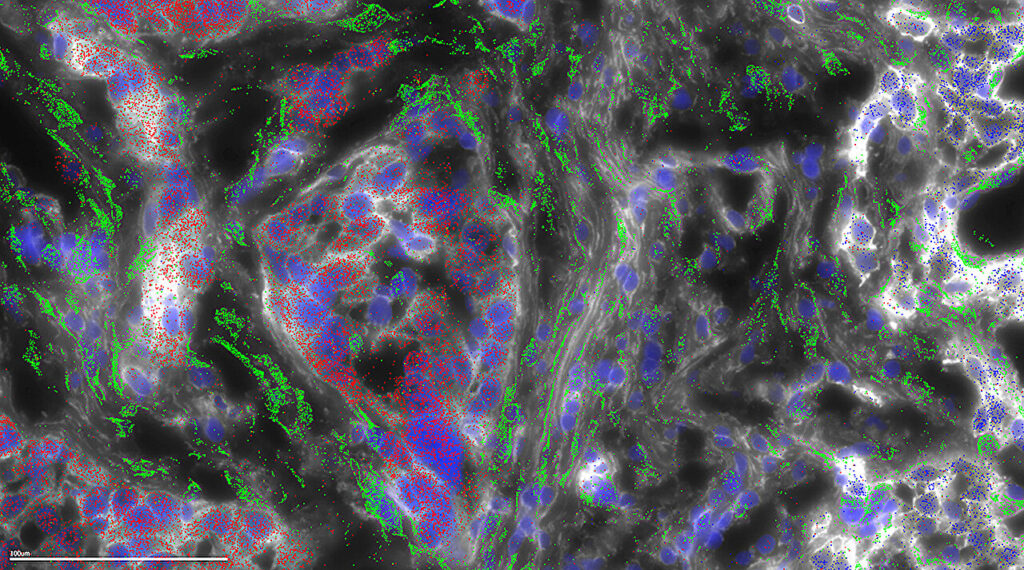
Le carcinome fibrolamellaire (FLC) tire son nom des bandes fibreuses de collagène qui traversent la tumeur. Dans la présente étude, la microscopie a été utilisée pour cartographier l’endroit où les différents gènes sont exprimés dans une tumeur FLC. Cette microscopie montre que le collagène n'est pas généré par les cellules tumorales FLC (rouges), mais plutôt par les cellules hôtes vaporeuses (vertes) appelées cellules étoilées, en réponse aux cellules FLC. Crédit : Université Rockefeller
Il a été extrêmement difficile d'identifier la cause de nombreux cancers, et beaucoup semblent avoir plus d'une origine. Le carcinome fibrolamellaire (FLC), cependant, est un cancer que les scientifiques pensaient avoir cerné.
Maladie rare et actuellement incurable qui attaque le foie des enfants, des adolescents et des jeunes adultes, la FLC est causée lorsqu'une petite délétion du chromosome 19 provoque la fusion de deux gènes, une découverte faite en 2014 dans le laboratoire de Sanford M. Simon de Rockefeller. , dont la propre fille alors adolescente, Elana, avait non seulement reçu un diagnostic de maladie du foie quelques années auparavant, mais était également l'un des principaux membres de l'équipe qui a découvert la fusion.
L'un des gènes est DNAJB1, qui produit des protéines de choc thermique qui favorisent l'homéostasie cellulaire, et l'autre est PRKACA, le générateur de la sous-unité catalytique de la protéine kinase A (PKA), essentielle à la fonction métabolique cellulaire. L'altération des kinases, qui modifient de nombreuses autres molécules, a été impliquée dans de nombreux cancers.
Au cours de la dernière décennie, on pensait que cette fusion créait un changement de type Frankenstein dans la PKA, provoquant ainsi des ravages dans la cellule. Les chercheurs du laboratoire de Simon ont fait une découverte surprenante : la protéine de fusion se comporte comme une kinase normale. Mais les cellules contenant un ajout à leur sous-unité catalytique génèrent la kinase en quantités excessives, ce qui est le véritable coupable.
“C'est en fait la surexpression d'une protéine appelée PKA qui provoque le cancer”, explique le premier auteur Mahsa Shirani, chercheur postdoctoral au Laboratoire de biophysique cellulaire dirigé par Simon. “Ces découvertes ont le potentiel de révéler les voies d'un large éventail de cancers et d'offrir de nouvelles possibilités de traitement.”
Les chercheurs ont publié leurs résultats dans Recherche contre le cancer.
Un manque d'inhibition
Les recherches de Shirani visent à mieux comprendre la mécanique du gène fusionné depuis son doctorat. étudiante et assistante d'enseignement dans le laboratoire de Barbara Lyons, biochimiste à l'Université d'État du Nouveau-Mexique, dont les recherches sur la FLC ont été motivées par le diagnostic de la maladie de son propre fils.
Comme Elana Simon et de nombreux autres patients, son fils, Jackson Clark, a mis sa vie entre parenthèses pour faire des recherches sur la maladie dans le laboratoire Simon. Son premier article du laboratoire a été publié l’année dernière. Clark est décédé du FLC.
Pour la présente étude, Shirani a analysé des échantillons de tissus tumoraux provenant de patients FLC en utilisant la spectrométrie de masse, la biochimie et l'immunofluorescence pour quantifier le niveau de protéine dans le tissu tumoral des patients. Elle les a également comparés aux tissus hépatiques normaux.
En creusant plus profondément, elle a découvert que les cellules tumorales présentaient un déséquilibre moléculaire : une quantité accrue de protéines catalytiques dépasse le nombre de protéines inhibitrices qui normalement tassent et localisent les premières. Cet excès a deux effets profonds sur la cellule. La première est que l’activité PKA s’intensifie, sans contrôle. L’autre est que la PKA est désormais libre de se déplacer dans la cellule, faisant des ravages dans des endroits auxquels elle ne peut généralement pas accéder, y compris le noyau.
Les résultats de Shirani indiquent que le fait que la sous-unité catalytique active annule ses composants inhibiteurs est ce qui est important, et non un changement structurel dans la kinase elle-même.
En testant cette théorie, les chercheurs ont découvert qu’ils pouvaient recréer la maladie dans les cellules hépatiques humaines simplement en augmentant la quantité de kinase normale. Ils ont également découvert que certains patients avaient un gène complètement différent fusionné à l'extrémité avant de la même kinase, PRKACA, ce qui indique que la cause réelle de la maladie ne pouvait pas être attribuée à la pièce supplémentaire ajoutée à la kinase.
“Nous avons montré que peu importe ce que vous avez fusionné avec le gène PRKACA. Cela pourrait être DNAJB1 ou ATP1B1, ou cela pourrait être rien du tout, juste PRKACA qui a une expression protéique élevée”, dit-elle. “Chaque situation conduit au même phénotype de cancer.”
Les chercheurs ont corroboré leurs conclusions à l’aide d’un outil unique à leur disposition. Au cours de la dernière décennie, le laboratoire Simon exploite le dépôt de tissus fibrolamellaires. Lorsque les chercheurs ont examiné leurs échantillons, ils ont découvert quatre patients présentant ce qui ressemblait à un fibrolamellaire mais n'ayant pas de fusion avec PRKACA. Au lieu de cela, la seule altération qu’ils ont trouvée était une perte de la protéine inhibitrice, fournissant davantage de preuves que la quantité de sous-unité catalytique par rapport à ses composants régulateurs était un facteur clé dans la formation de la maladie.
Horizon de traitement
Les résultats pourraient potentiellement conduire aux premiers traitements thérapeutiques du FLC au-delà de l’ablation chirurgicale des tumeurs, explique Shirani. (Les traitements disponibles pour les personnes atteintes d'un cancer du foie courant sont inutiles pour le FLC, qui a un profil moléculaire complètement différent.)
Une idée consiste à localiser les sites de liaison sur la protéine DNAJB1 auxquels un inhibiteur de médicament pourrait se lier. Une autre consiste à modérer l’expression de la PKA. Le laboratoire étudie actuellement les deux possibilités.
Cette dernière approche pourrait avoir un potentiel au-delà du FLC, dit Shirani, car la dérégulation de la PKA est liée à de nombreuses autres maladies. Par exemple, la tumeur surrénalienne responsable du syndrome de Cushing est le résultat d’une mutation dans la même sous-unité catalytique, PRKACA. (Cette découverte a été faite par le président de Rockefeller, Richard P. Lifton, en 2014.)
Comme pour un traitement potentiel par FLC, la clé serait d'interférer avec les processus de signalisation en aval de la production de PKA, avant que le geyser de production de protéines ne perturbe la cellule.
Shirani suggère également que la mesure des niveaux de protéines produites par des gènes mutés pourrait être une première étape vers une meilleure compréhension d'un certain nombre de cancers : “Peut-être que l'augmentation du niveau ou de l'emplacement des protéines en est elle-même la cause.”
Les résultats peuvent également éclairer la pathogenèse de la maladie en général, l'une des nombreuses raisons importantes pour enquêter sur les maladies rares, qui sont souvent considérées comme insignifiantes car elles touchent si peu de personnes, explique Simon.
“Il y a tellement de bonnes raisons de les étudier”, dit-il. “De nombreuses maladies rares sont caractérisées de manière très précise, ce qui permet de réaliser des progrès rapides, et ces résultats peuvent souvent être généralisés à des maladies courantes. Par exemple, nous avons découvert le concept de” suppresseur de tumeur “en étudiant le rétinoblastome, un cancer rare chez l'enfant.”
“Je pense également qu'à mesure que nous définissons les maladies avec plus de précision, nous constatons que bon nombre de celles que l'on pensait être des maladies uniques sont en réalité des ensembles de différentes maladies rares partageant des caractéristiques ou des mécanismes communs”, ajoute-t-il.
Plus d'information:
Shirani M. et al. L'activité accrue de la protéine kinase A induit des caractéristiques de carcinome hépatocellulaire fibrolamellaire indépendantes de DNAJB1. Recherche contre le cancer (2024). DOI : 10.1158/0008-5472.CAN-23-4110 aacrjournals.org/cancerres/art… eA-Activity-Induces
Fourni par l'Université Rockefeller
Citation: Origines surprenantes d'un cancer rare : une étude révèle que la surexpression de la protéine PKA provoque un carcinome fibrolamellaire (18 juin 2024) récupéré le 18 juin 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.