Crédit: Journal d'investigation clinique (2024). DOI : 10.1172/JCI161660
Une nouvelle approche d'immunothérapie développée par les scientifiques de Ludwig Cancer Research utilise une attaque à deux volets contre les tumeurs solides pour renforcer la capacité du système immunitaire à cibler et à éliminer les cellules cancéreuses.
La recherche se concentre sur une immunothérapie appelée transfert cellulaire adoptif (ACT), qui consiste à extraire les cellules T d'un patient, à améliorer leur capacité à combattre le cancer, à les développer en culture et à les réinjecter dans le corps du patient.
“Alors que les thérapies par cellules T ont montré un énorme succès dans le traitement de certains cancers du sang, les tumeurs solides présentent un défi plus complexe en raison des mécanismes immunosuppresseurs en jeu dans le microenvironnement tumoral”, a déclaré Melita Irving de Ludwig Lausanne, qui a dirigé l'étude. “Les lymphocytes T à eux seuls pourraient ne pas suffire, c'est pourquoi nous étudions des moyens d'accroître leur efficacité en intégrant d'autres stratégies de renforcement du système immunitaire.”
Dans l'étude, détaillée dans le Journal d'investigation cliniqueIrving et son équipe ont modifié les cellules T pour sécréter CV1, une version à haute affinité de la protéine alpha régulatrice du signal humain (SiRPα).
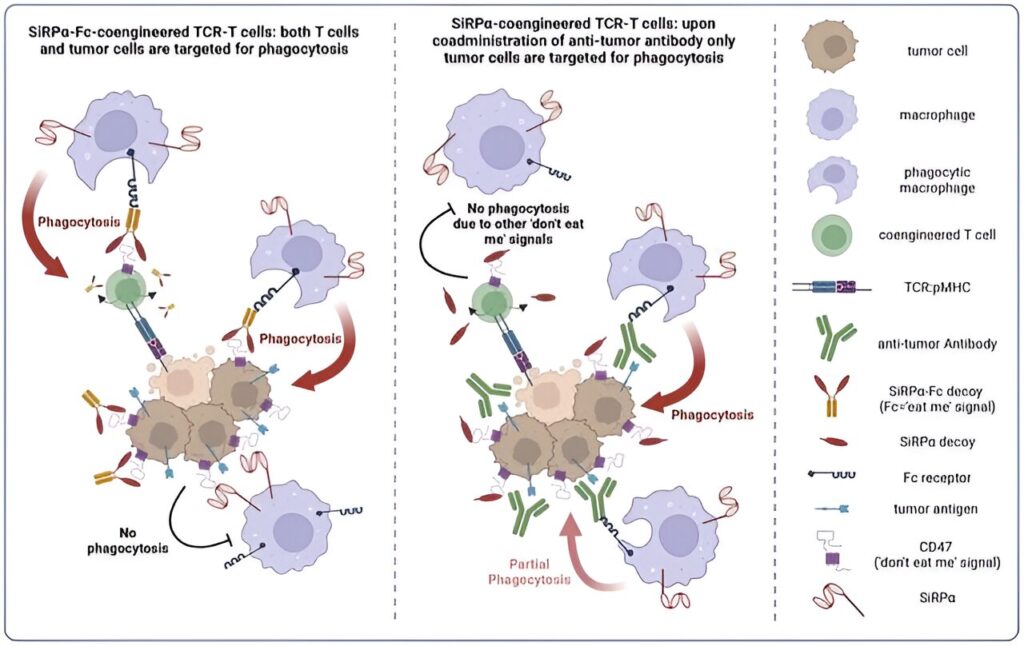
SiRPα interagit normalement avec CD47, une protéine présente à la surface des cellules saines qui transmet un signal « ne me mange pas » pour empêcher les macrophages de les engloutir. Cependant, de nombreuses cellules cancéreuses exploitent ce système en surexprimant CD47 pour éviter d'être mangées ou « phagocytées ».
“Le système immunitaire inné, en particulier les macrophages, qui peuvent consommer les cellules tumorales, est crucial pour nos défenses immunitaires contre le cancer”, a expliqué Irving. (Les lymphocytes T appartiennent à un bras distinct du système immunitaire appelé système immunitaire adaptatif.)
Le leurre CV1 précédemment développé et utilisé par l'équipe d'Irving lie le CD47 avec une affinité élevée, faisant taire efficacement le signal « ne me mange pas ». On s'attendait à ce que cela rende les cellules cancéreuses plus reconnaissables et plus sensibles aux attaques des macrophages alors qu'elles étaient simultanément ciblées par les cellules T modifiées, qui avaient également été co-conçues pour exprimer un récepteur de cellules T (TCR) à affinité optimisée.
Cependant, l'équipe a rencontré un problème inattendu. Le CV1 que leurs cellules T ont été conçues pour sécréter comprenait une queue Fc, qui se trouve habituellement à l’extrémité d’une molécule d’anticorps et sert également d’étiquette qui attire l’attaque des macrophages. Étant donné que cette étiquette recouvrait désormais les cellules T sécrétant le CV1 modifié, elle a provoqué une attaque complète des macrophages contre les cellules T thérapeutiques, conduisant à leur épuisement chez les souris traitées.
Pour corriger cela, Evangelos Stefanidis, premier auteur de l'étude et récent doctorat. diplômé du groupe d'Irving, a modifié les cellules T pour exprimer CV1 seul, sans la queue Fc. Cela a empêché les cellules T modifiées d’être ciblées par les macrophages humains.
De plus, la combinaison de ces cellules T productrices de CV1 avec des anticorps ciblant le cancer tels que l'avelumab et le cétuximab a encore amélioré la capacité des macrophages à consommer les cellules tumorales. En effet, ces anticorps – qui ciblent respectivement la molécule immunosuppressive PD-L1 et le récepteur du facteur de croissance épidermique (EGFR) favorisant la croissance – possèdent des queues Fc actives qui engagent les macrophages pour attaquer spécifiquement les cellules tumorales. L’équipe a également observé que le traitement des souris avec ces anticorps modifiait favorablement le microenvironnement tumoral pour soutenir l’attaque immunitaire.
“En supprimant la queue Fc, nous pourrions épargner les cellules T des macrophages humains, et en combinant les cellules T co-conçues avec des anticorps cliniques comprenant une queue Fc active, nous avons spécifiquement augmenté la phagocytose des cellules tumorales par les macrophages”, a expliqué Irving.
Les résultats pourraient également aider à expliquer pourquoi les essais cliniques du magrolimab, un médicament anticorps, ont été confrontés à des défis importants, notamment de mauvaises réponses des patients et des infections. Comme le leurre CV1, le magrolimab bloque le signal CD47 « ne me mange pas » sur les cellules tumorales pour favoriser leur destruction par le système immunitaire. Mais si, comme les leurres CV1 à queues Fc, son action bloquante ne cible pas exclusivement les cellules cancéreuses, elle pourrait provoquer la destruction des tissus sains.
“Il est possible que le magrolimab cible également les cellules immunitaires, y compris les cellules T, pour la phagocytose”, a déclaré Irving. “Notre stratégie de traitement combiné aide à diriger la phagocytose spécifiquement contre les cellules tumorales tout en épargnant nos cellules T modifiées. Nos résultats mettent également en évidence la complexité du traitement du cancer et l'importance d'une approche nuancée de l'immunothérapie.”
Plus d'information:
Evangelos Stefanidis et al, La combinaison de cellules T et d'anticorps co-conçus avec leurre SiRPα augmente la phagocytose médiée par les macrophages des cellules tumorales, Journal d'investigation clinique (2024). DOI : 10.1172/JCI161660
Fourni par l'Institut Ludwig pour la recherche sur le cancer
Citation: Une stratégie d'attaque à deux volets stimule l'immunothérapie dans les études précliniques (3 juin 2024) récupéré le 3 juin 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.