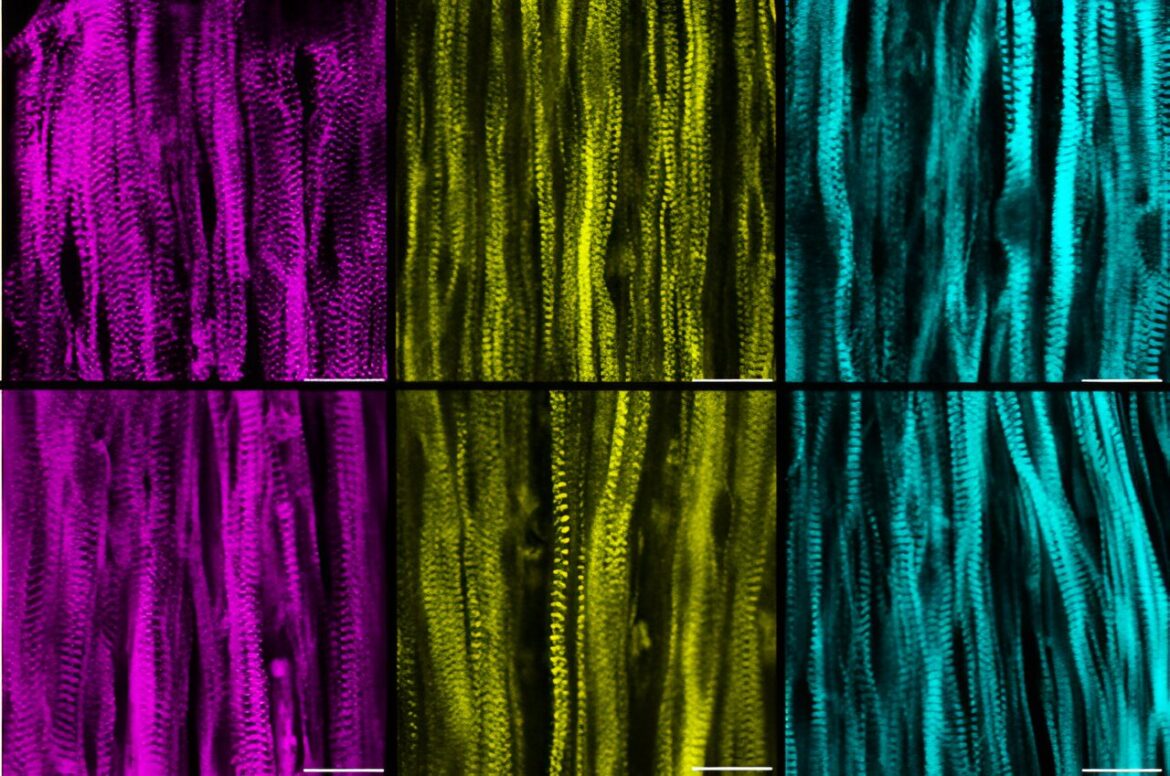
La rangée supérieure de photos montre une vue microscopique de fibres musculaires saines colorées pour révéler diverses irrégularités, tandis que la rangée inférieure montre la même chose, mais pour les fibres musculaires touchées par la maladie LGMD2B. Remarquez-vous des différences ? Les experts non plus, révélant que les effets de la maladie ne sont pas causés par des malformations physiques au sein des muscles. Crédit : Alastair Khodabukus, Université Duke
Les ingénieurs biomédicaux de l'Université Duke ont développé une nouvelle technique pour mieux comprendre et tester les traitements d'un groupe de troubles musculaires extrêmement rares appelés dysferlinopathie ou dystrophies musculaires des ceintures 2B (LGMD2B). L’approche permet de développer des tissus musculaires 3D complexes et fonctionnels à partir de cellules souches en laboratoire, créant ainsi une plate-forme qui reproduit les symptômes du patient et les réponses au traitement.
Dans leur première étude, les chercheurs révèlent certains des mécanismes biologiques à la base de la perte caractéristique de mobilité provoquée par LGMD2B. Ils démontrent également qu’une combinaison de traitements existants pourrait atténuer certains des pires symptômes de la maladie.
Les résultats paraissent dans le journal Science avancée.
LGMD2B ne touche qu’environ huit personnes par million dans le monde. Contrairement à sa cousine plus connue et plus courante, la dystrophie musculaire de Duchenne, la maladie touche à la fois les hommes et les femmes, se manifeste plus tard dans la vie, à la fin de l'adolescence ou au début de la vingtaine, et est rarement mortelle. Cependant, les patients LGMD2B développent une faiblesse sévère au niveau des jambes et des épaules, les obligeant généralement à utiliser des fauteuils roulants pour le reste de leur vie.
Causée par une maladie génétique, LGMD2B empêche l’organisme de créer une forme entièrement fonctionnelle d’une protéine appelée dysferline. Il n’existe actuellement aucun traitement ou remède approuvé. Ce manque d’options s’explique en partie par les nombreuses fonctions de la dysferline, notamment le colmatage des trous dans les membranes musculaires, la régulation des équilibres calciques nécessaires à la contraction musculaire et le contrôle du métabolisme cellulaire. Et pour des raisons inconnues, les muscles affectés accumulent d’abord de la graisse dans les fibres musculaires elles-mêmes avant de dégénérer et d’être finalement remplacés par des cellules adipeuses.
“Ce phénomène est très rare même pour les dystrophies musculaires”, a déclaré Nenad Bursac, professeur de génie biomédical à Duke. “C'est une question brûlante au sein de la communauté de savoir pourquoi cela se produit.”
L’un des défis auxquels sont confrontés les chercheurs qui tentent de résoudre ces problèmes est que le modèle murin utilisé pour se rapprocher de LGMD2B présente des symptômes très légers par rapport à ceux des patients. Les souris atteintes de la maladie sont toujours capables de marcher, et cela ne se manifeste que près d'un an après le début de leur durée de vie de deux ans, ce qui rend les études sur la maladie extrêmement lentes.
La dysferline est exprimée dans d'autres types de cellules et les taux sanguins de carburants métaboliques tels que le cholestérol sont également modifiés chez les souris et les patients. Ensemble, cela complique la recherche sur LGMD2B en rendant difficile l'évaluation des types de cellules responsables de la maladie et si les changements métaboliques sont dus à la perte de dysferline elle-même ou à des effets sur l'ensemble du corps.
Pour contourner ces défis, Bursac et son chercheur Alastair Khodabukus se sont tournés vers une plateforme musculaire technique qu'ils développent depuis près d'une décennie. Le laboratoire de Bursac a été le premier à développer des muscles squelettiques humains fonctionnels et contractuels dans une boîte de Pétri et a depuis lors amélioré ses processus pour permettre des études sur la force, le métabolisme et la réparation musculaires. Ce système leur a permis de concentrer leur étude uniquement sur les effets de la dysferline sur les muscles squelettiques, sans complications liées à d’autres types de cellules ni altération des profils de métabolites sanguins.
Dans l'étude, les chercheurs ont commencé avec des cellules souches pluripotentes induites (IPSC) dérivées de patients vivant avec LGMD fournies par la Fondation Jain, un organisme de bienfaisance axé sur la recherche d'un remède contre LGMD2B. Grâce à leurs techniques de croissance musculaire, le laboratoire a transformé ces cellules souches en fibres musculaires et les a soumises à une batterie de tests pendant six semaines.

Un ensemble de boîtes de Pétri abritant chacune une plate-forme permettant la croissance de fibres musculaires à partir de cellules souches. Le laboratoire de Bursac a été le premier à développer des muscles squelettiques humains fonctionnels et contractuels dans une boîte de Pétri et a depuis lors amélioré ses processus pour permettre des études sur la force, le métabolisme et la réparation musculaires. Crédit : Alastair Khodabukus, Université Duke
Comme les muscles trouvés chez les patients eux-mêmes, les versions cultivées en laboratoire présentaient une grande variété de problèmes.
“Dans l'ensemble, notre modèle a répété un grand nombre de manifestations cliniques de la maladie et d'observations faites chez des patients réels, mais tout a été réalisé dans une boîte de Pétri”, a déclaré Bursac. “Nous avons pu acquérir de nouvelles connaissances sur les aspects musculaires spécifiques de la maladie.”
Les chercheurs ont découvert que la perte de force musculaire n’était pas le résultat de déficiences dans la structure ou la taille des muscles, mais dans leur gestion du calcium. Les contractions musculaires sont physiquement causées par la libération des réservoirs de calcium dans les cellules musculaires et leur liaison aux protéines musculaires. Des tests ont montré que les cellules musculaires malades avaient des fuites dans leurs réserves de calcium, ce qui entraînait une diminution de la libération de calcium et des contractions plus faibles.
Les chercheurs ont également montré que le manque de dysferline provoquait des dommages irréparables aux cellules musculaires et que l'incapacité à brûler les acides gras pour la production d'énergie était au moins en partie responsable de l'accumulation de graisse dans les fibres musculaires, ce qui a longtemps intrigué les médecins. communauté.
“Nous avons reproduit quelque chose observé chez des patients et montré que cela n'était pas dû à des facteurs environnementaux au sein du corps, mais à des problèmes au sein du muscle lui-même”, a déclaré Khodabukus.
Les chercheurs ont ensuite testé les effets de deux médicaments candidats pour traiter potentiellement la maladie, identifiés grâce à des modèles murins mais n'ayant pas encore été testés chez l'homme. L'un d'eux, le dantrolène, est censé empêcher le calcium de s'échapper des réservoirs des cellules musculaires. Le second, appelé vamorolone, a récemment été approuvé pour une utilisation chez les patients atteints de dystrophie musculaire de Duchenne, bien que les chercheurs ne comprennent pas pleinement son fonctionnement.
Ensemble, les médicaments ont empêché la fuite de calcium et ont aidé la membrane cellulaire à se réparer, rétablissant ainsi une grande partie de la force musculaire. Et même s’ils ont également contribué à réduire la quantité de graisse accumulée dans les muscles, ils ne l’ont pas complètement empêché et n’ont pas non plus aidé les muscles à brûler efficacement les graisses comme carburant.
À l’avenir, le groupe prévoit d’ajouter des cellules immunitaires et adipeuses à ses expériences pour une plus grande complexité. Ils cherchent également à mieux comprendre les perturbations du métabolisme cellulaire et à trouver de nouveaux médicaments qui rétablissent entièrement la force, la réparation et le déficit métabolique.
“À l'heure actuelle, nous disposons d'un système de base uniquement musculaire, ce qui est formidable pour voir les effets de la maladie dans le muscle lui-même, mais ce qui est également important, c'est la diaphonie entre les cellules immunitaires, les cellules adipeuses et les cellules musculaires”, a déclaré Khodabukus. “En développant davantage notre système, nous espérons être en mesure de comprendre pleinement ce qui entraîne la perte de muscle et son remplacement par de la graisse chez ces patients.”
Plus d'information:
Alastair Khodabukus et al, Le modèle bio-ingénierie du muscle squelettique LGMD2B humain révèle les rôles de la surcharge en calcium intracellulaire dans le dysfonctionnement contractile et métabolique dans la dysferlinopathie, Science avancée (2024). DOI : 10.1002/advs.202400188
Fourni par l'Université Duke
Citation: Les muscles cultivés en laboratoire révèlent les mystères des maladies musculaires rares (21 juin 2024) récupéré le 21 juin 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.