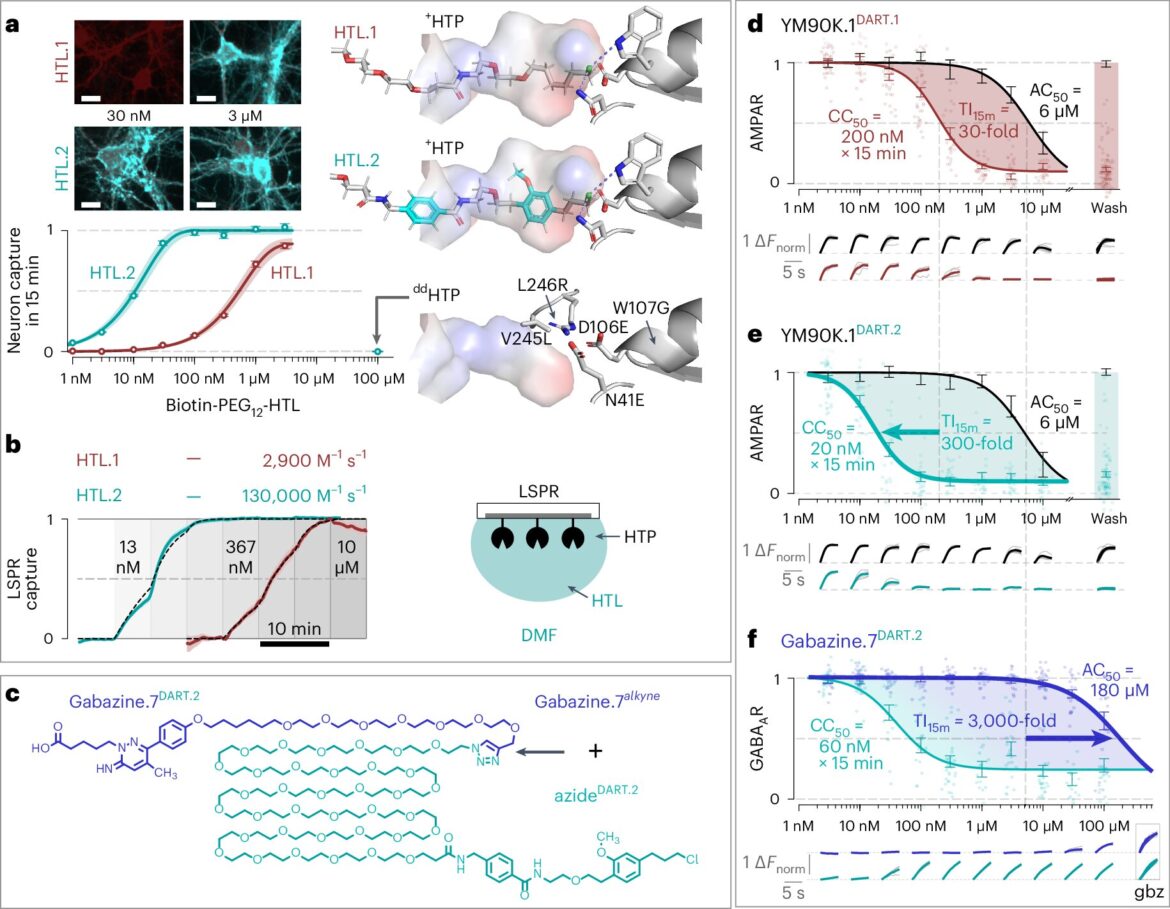
DART.2 atteint une spécificité cellulaire mille fois supérieure. un, développement HTL.2. Le coin supérieur gauche montre un CC neuronal50 essai: +Expression HTP estimée via dTomato (rouge foncé) ; biotine-PEG capturée12-HTL (après 15 min d'incubation) quantifié avec de la streptavidine (cyan). Le coin inférieur gauche montre les données dose-réponse de 16 lamelles. La droite montre le modèle structurel du HTP avec HTL.1 (en haut), HTL.2 (au milieu) et jjMutations HTP (en bas). bTest recombinant. cChimie modulaire. ré, etest AMPAR. FGABAUNTest R. Crédit: Méthodes naturelles (2024). DOI : 10.1038/s41592-024-02292-9
Les ingénieurs biomédicaux de l'Université Duke ont développé une méthode pour administrer des médicaments à des types spécifiques de neurones dans tout le cerveau. Cette nouvelle approche, testée chez la souris, s'est avérée 100 fois plus précise que les méthodes existantes et permet aux chercheurs d'étudier plus efficacement les maladies neurologiques et d'explorer des traitements médicamenteux efficaces et ciblés.
La recherche a été publiée le 14 juin dans la revue Méthodes naturelles.
Les médecins et les chercheurs s’appuient depuis longtemps sur les médicaments pour étudier les connexions complexes entre les neurones et traiter les maladies neurologiques. Mais ces médicaments manquent également d’une caractéristique clé pour atteindre pleinement ces objectifs : la précision.
Les médicaments sont conçus pour se lier à des récepteurs spécifiques afin de déclencher une réponse, mais des millions de cellules peuvent exprimer le même récepteur. Cela signifie que lorsqu’une personne prend un médicament, celui-ci affecte toutes ces cellules en même temps, déclenchant des effets secondaires non ciblés et rendant difficile pour les chercheurs d’identifier les signaux cellulaires clés impactés par le produit pharmaceutique.
Michael Tadross et ses collaborateurs ont cherché à remédier à ce problème avec la création de DART, ou Drug Acutely Restricted by Tethering. La première itération de cet outil a permis aux chercheurs d'administrer des produits pharmaceutiques à des types de cellules spécifiques du cerveau en introduisant une protéine qui recouvre leurs surfaces et attire les médicaments chargés avec un dispositif de guidage spécial.
Lorsqu’un médicament est introduit dans le système, il est capturé par cette balise et crée localement une concentration élevée du médicament autour des cellules ciblées.
Dans l’itération originale, le système de référence permettait aux médicaments de s’accumuler localement sur les cellules souhaitées, atteignant des concentrations environ 30 fois supérieures à celles de n’importe quel autre endroit du cerveau en quelques minutes. Cela a bien fonctionné dans la plupart des cas, mais ce n'était pas une solution générale.
“Pensez aux molécules de médicaments comme les acheteurs d'un magasin que vous aimeriez acheter un article spécifique. Certains acheteurs peuvent y arriver rapidement, mais d'autres seront distraits par d'autres articles dans le magasin et provoqueront un certain chaos. Tout comme ceux-ci acheteurs, nos médicaments peuvent avoir des effets inattendus sur leur chemin vers leur cible », explique Tadross, professeur adjoint de génie biomédical.
Aujourd'hui, Tadross et ses collègues ont présenté DART.2, la deuxième itération de leur outil. Bénéficiant d'un système de capture de médicaments optimisé, cette version est 100 fois plus précise que son prédécesseur, permettant aux cellules cibles de capturer des médicaments à des concentrations jusqu'à 3 000 fois supérieures à celles de n'importe quel autre endroit du cerveau en seulement 15 minutes.
Cette précision améliorée permettra aux chercheurs d’utiliser des médicaments sur des animaux vivants, ce qui était auparavant impossible. Comme preuve de concept, les chercheurs ont expérimenté la gabazine, un médicament qui empêche le neurotransmetteur GABA (acide gamma-aminobutryique) de se lier aux récepteurs GABA.
“Nous avons essayé d'utiliser la gabazine avec notre outil DART initial, mais ce n'était pas assez efficace”, a déclaré Tadross. “Notre système optimisé a résolu ce problème, permettant d'administrer en toute sécurité de la gabazine aux neurones ciblés sans déclencher de réponse épileptique hors cible.”
En tant que neurotransmetteur inhibiteur, le GABA limite la capacité d'un neurone à envoyer et à recevoir des signaux, produisant ainsi un effet calmant. Mais en empêchant le GABA de se lier à ses récepteurs, la gabazine peut augmenter l'activité neuronale.
Il s’agit d’un outil essentiel qui aide les chercheurs à étudier les récepteurs GABA dans le cadre d’expériences hautement contrôlées et limitées, par exemple en culture cellulaire ou dans une tranche de cerveau. Mais auparavant, son utilisation chez les animaux vivants était très difficile, car même de faibles doses pouvaient déclencher des convulsions.
Dans une démonstration des capacités de DART.2, l'équipe a utilisé la gabazine pour explorer le rôle des récepteurs GABA dans la zone tegmentale ventrale, une région du cerveau associée à des comportements tels que la dépendance, le contrôle du stress, la mémoire et le mouvement.
Des études antérieures suggéraient que les récepteurs GABA de cette région du cerveau agissent comme une pédale d'accélérateur, rendant les souris plus actives. Étonnamment, DART.2 a montré que le contraire était vrai pour les récepteurs GABA sur les neurones dopaminergiques : les récepteurs GABA sur ces cellules servaient de pédale de frein, obligeant les souris à ralentir comme si elles prenaient le temps de délibérer sur leurs actions.
La précision accrue de DART.2 a également permis aux chercheurs d’utiliser une voie d’administration plus simple. Lors de travaux antérieurs, l’équipe avait utilisé une canule pour appliquer le médicament à proximité de sa cible. Mais avec la nouvelle version de DART, cela n'est plus nécessaire.
Ils ont démontré une administration via le liquide céphalo-rachidien, permettant au médicament de circuler dans tout le cerveau. Le système DART.2 fonctionne suffisamment efficacement pour concentrer le médicament sur la région spécifique du cerveau et les cellules d'intérêt, tandis que le reste du cerveau subit des effets négligeables hors cible.
“Maintenant, l'analogie devient comme une vente du Black Friday où les articles d'intérêt portent des panneaux qui conduisent tout le monde directement aux articles en vente”, a déclaré Tadross. “La même chose était vraie lorsque nous avons administré les médicaments à l'ensemble du cerveau.”
Inspirée par les meilleures pratiques des essais cliniques, l’équipe a également développé des méthodes pour confirmer l’engagement des cibles. Ils l'ont fait avec des traceurs fluorescents qui peuvent être mélangés et associés à n'importe quel médicament, permettant aux chercheurs de visualiser où et quelle quantité de médicament a été administrée.
Comme test final pour l'outil mis à jour, l'équipe a montré que DART.2 pouvait précisément administrer des médicaments pour inhiber et renforcer les deux principales formes de transmission synaptique dans le cerveau. Ainsi, non seulement ils bloquaient les récepteurs GABA, mais pourraient les rendre plus sensibles au GABA.
Ils ont également étendu l'approche aux récepteurs AMPA, qui détectent le glutamate, un neurotransmetteur excitateur qui assure la majorité du transfert d'informations entre les neurones du cerveau.
Tadross et ses collaborateurs ont déjà des idées pour la prochaine itération de DART. La première consiste à développer un système capable de traverser la barrière hémato-encéphalique. Ils aimeraient également développer un nouveau traceur qui leur permettrait de suivre l'emplacement et la concentration de médicaments en utilisant l'imagerie non invasive sur des animaux vivants.
« Notre première étude avec DART en 2017 était une preuve de concept », a déclaré Tadross. “L'idée était d'une simplicité trompeuse : nous voulions qu'un médicament agisse dans un endroit et ne fonctionne pas dans un autre endroit, et nous l'avons fait en contrôlant la concentration du médicament.
“Maintenant, en étendant l'approche à davantage de médicaments et en montrant à quel point nous pouvons optimiser le système de manière radicale, nous passons à l'étape suivante. C'est très excitant.”
Plus d'information:
Brenda C. Shields et al, DART.2 : pharmacologie synaptique bidirectionnelle avec une spécificité cellulaire mille fois supérieure, Méthodes naturelles (2024). DOI : 10.1038/s41592-024-02292-9
Fourni par l'Université Duke
Citation: Un dispositif de référencement basé sur des protéines délivre avec précision des médicaments aux neurones cibles (18 juin 2024) récupéré le 18 juin 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.