Crédit: Neurone (2024). DOI: 10.1016/j.neuron.2024.05.003
Deux études récentes dirigées par Joseph Mazzulli, Ph.D., professeur agrégé à la division des troubles du mouvement du département de neurologie Ken & Ruth Davee, ont découvert des mécanismes cellulaires jusqu’alors inconnus impliqués dans l’agrégation et le mauvais repliement des protéines neuronales, caractéristiques clés de la maladie de Parkinson. .
Publié dans Neurone et Communications naturellesles résultats mettent en évidence plusieurs nouvelles voies qui soutiennent la pathogenèse et peuvent servir de cibles thérapeutiques pour restaurer la fonction neuronale chez les patients atteints de la maladie de Parkinson et d’autres maladies neurodégénératives.
Une caractéristique des maladies neurodégénératives, notamment la maladie de Parkinson et la démence à corps de Lewy, est l’agrégation d’une protéine appelée alpha-synucléine, présente dans le tissu nerveux.
Dans les cellules saines, la protéine aide les neurotransmetteurs à voyager entre les neurones ; cependant, dans les neurones affectés par la maladie de Parkinson, la protéine se replie mal et s’agrège en gros amas (corps de Lewy), ce qui peut endommager les neurones en provoquant une inflammation et un dysfonctionnement mitochondrial et lysosomal.
Des travaux antérieurs du laboratoire Mazzulli ont montré que les déficits induits par l’alpha-synucléine dans le trafic entre le réticulum endoplasmique et l’appareil de Golgi conduisent à une accumulation de protéines qui sont incapables de sortir du réticulum endoplasmique et de pénétrer dans le lysosome, perturbant ainsi les voies d’élimination des déchets dans la cellule et provoquant une agrégation de protéines.
Dans la nouvelle étude publiée dans NeuroneL’équipe de Mazzulli visait à identifier les protéines susceptibles de s’agréger dans les neurones affectés par la maladie de Parkinson en analysant les cultures de cellules souches pluripotentes induites (iPSC) du mésencéphale dérivées de patients atteints de la maladie de Parkinson familiale et de démence à corps de Lewy.
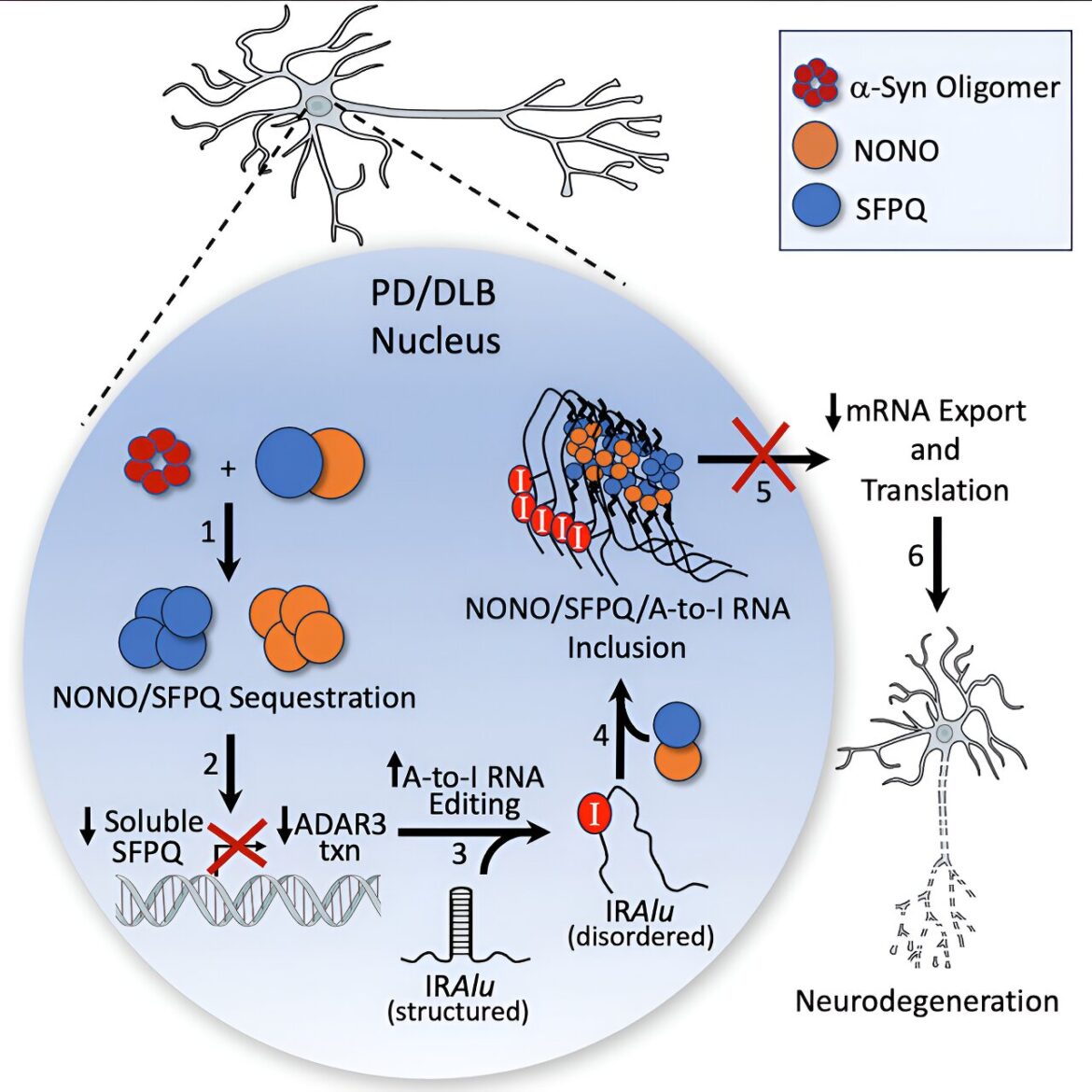
La pathologie de l’alpha-synucléine se trouve généralement dans le cytoplasme des neurones, selon Mazzulli. Cependant, en utilisant une approche de criblage protéomique impartiale, son équipe a découvert de manière inattendue un ensemble de protéines de liaison à l’ARN accumulées dans le noyau : NONO et SFPQ.
« Ce sont des protéines intéressantes car elles se lient à l’ARN et appartiennent à une classe de protéines flexibles qui sont conçues pour changer délibérément de forme entre des formes solubles et des particules insolubles, appelées paraspeckles, de manière réversible.
“Dans les neurones de Parkinson, cependant, NONO et SFPQ forment des inclusions insolubles anormalement grandes dans le noyau qui sont incapables de revenir à leur état soluble normal et fonctionnel”, a déclaré Mazzulli.
Les chercheurs ont découvert qu’une fois les protéines agrégées, elles réduisaient l’expression de l’inhibiteur d’édition d’ARN ADAR3 et, à leur tour, augmentaient l’édition d’ARN adénosine-inosine (A-à-I) dans le noyau, affectant l’expression et la fonction des protéines neuronales vitales.
“Le domaine s’est vraiment concentré sur l’agrégation de l’alpha-synucléine. Nous ne disons pas que ce n’est pas important, mais nous montrons qu’il existe d’autres protéines et inclusions d’ARN impliquées dans la pathogenèse de la maladie de Parkinson que nous n’avons jamais vues auparavant.
“L’utilisation de méthodes comme celle-ci, où nous examinons les neurones des patients in vitro, nous a amenés à découvrir cette nouvelle pathologie composée à la fois d’agrégats d’ARN et de protéines dans le cerveau des patients”, a déclaré Mazzulli.
« Plus d’un quart de siècle après la découverte de l’alpha-synucléine dans les corps de Lewy des patients atteints de la maladie de Parkinson, nos recherches mettent en évidence l’existence de nouveaux agrégats de protéines de liaison à l’ARN ainsi que d’ARN aberrant édité par l’IA.
« Cela remet en question notre compréhension actuelle de la pathologie de Parkinson et offre des opportunités passionnantes pour de nouvelles cibles thérapeutiques axées sur la voie d’édition de l’ARN », a déclaré Nandkishore Belur, MS, chercheur associé au laboratoire Mazzulli et auteur principal de l’étude.
Dans l’autre étude, publiée dans Nature CommunicationsMazzulli et ses collègues visaient à mieux comprendre les mécanismes qui lient le métabolisme du glucose et le mauvais repliement des protéines dans les neurones affectés par la maladie de Parkinson.
En suivant une méthodologie similaire à celle de l’étude précédente, l’équipe de Mazzulli a analysé les neurones dans les cultures de mésencéphale iPSC dérivées de patients atteints de la maladie de Parkinson et a découvert la perturbation d’une voie métabolique, la voie de l’hexosamine, qui est importante pour la synthèse, le transport et le repliement des protéines dans le réticulum endoplasmique du neurone.
La voie de l’hexosamine produit des glycanes liés à l’azote, des molécules essentielles qui soutiennent le repliement des protéines dans le réticulum endoplasmique. Cependant, dans les cultures du mésencéphale de Parkinson, ce processus de N-glycosylation a été interrompu, provoquant un mauvais repliement et une accumulation des protéines.
« Nous avons découvert une enzyme métabolique dans la voie de l’hexosamine qui était épuisée, appelée GFPT2. C’est une enzyme importante qui fournit les précurseurs de la N-glycosylation. Si vous l’éliminez, le repliement des protéines dans le réticulum endoplasmique est gravement compromis, ce qui conduit à un stress du protéome », a déclaré Mazzulli.
En utilisant une approche pharmaceutique, les enquêteurs ont inséré de la n-acétylglucosamine, un composant clé de la voie de l’hexosamine, dans les neurones et ont découvert que cette approche rétablissait l’activité lysosomale et améliorait le repliement des protéines dans le réticulum endoplasmique.
À l’avenir, Mazzulli a déclaré que son équipe espère tester des approches pharmaceutiques et génétiques pour restaurer l’expression de GFPT2 dans des modèles de souris alpha-synucléine afin de déterminer si ces traitements augmentent l’activité lysosomale et la clairance des protéines dans le cerveau.
“Quand on pense aux traitements contre la maladie de Parkinson, tout ce qui est actuellement au stade préclinique ou en essais cliniques cible une seule voie. Nos études montrent que plusieurs voies sont perturbées dans la maladie, et nous pensons donc qu’il est essentiel de sauver plusieurs voies à la fois. modification”, a déclaré Mazzulli.
Plus d’information:
Nandkishore R. Belur et al, Agrégats nucléaires de NONO/SFPQ et d’ARN édité A à I dans la maladie de Parkinson et la démence à corps de Lewy, Neurone (2024). DOI: 10.1016/j.neuron.2024.05.003
Willayat Y. Wani et al, La voie biosynthétique de l’hexosamine sauve le dysfonctionnement lysosomal chez les patients atteints de la maladie de Parkinson, les neurones du mésencéphale dérivés d’iPSC, Communications naturelles (2024). DOI: 10.1038/s41467-024-49256-3
Fourni par l’Université Northwestern
Citation:De nouveaux mécanismes cellulaires découverts dans la maladie de Parkinson (1er juillet 2024) récupéré le 1er juillet 2024 à partir de
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni à titre d’information uniquement.