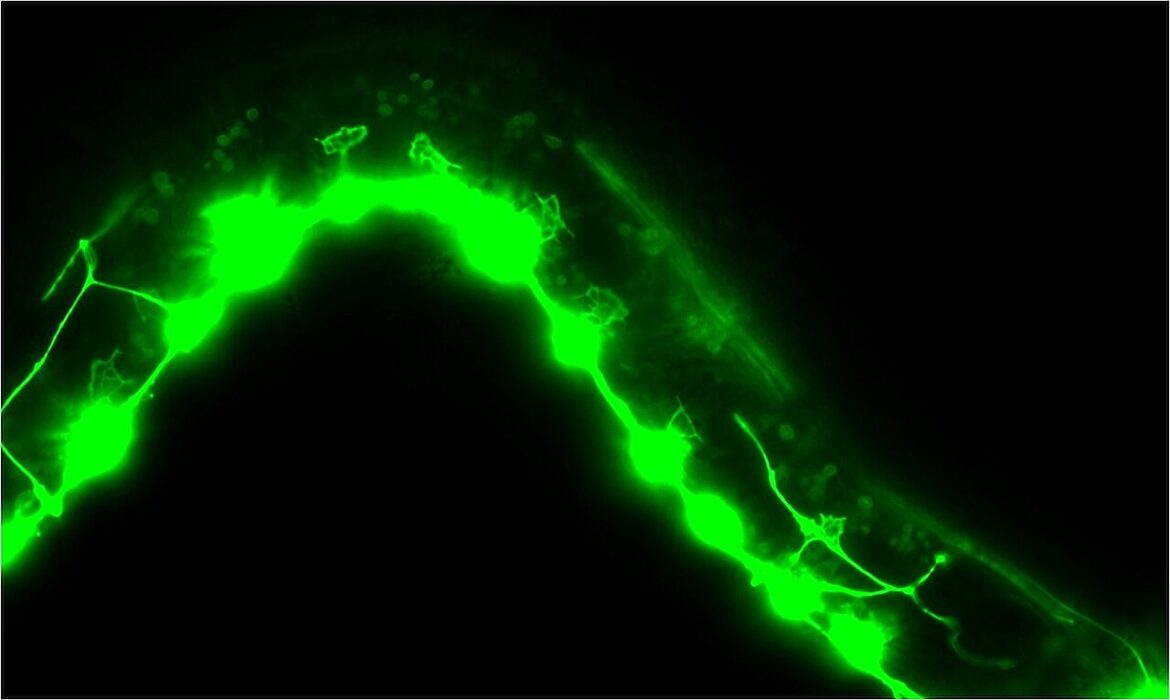
Les taches pâles au-dessus des taches brillantes sont des cônes de croissance axonale, des structures qui guident les axones vers leurs cibles dans le système nerveux. Lorsque src-1 disparaît (photo ci-dessus), les cônes de croissance sont grands et ne peuvent pas se concentrer là où ils vont. Crédit : Snehal Mahadik
De nombreuses personnes connaissent les oncogènes, des gènes connus depuis longtemps pour être impliqués dans les cancers chez l’homme, comme le gène Src. Ce qui est moins largement compris, c’est que les oncogènes n’ont pas évolué uniquement pour provoquer le cancer chez les espèces, mais plutôt pour contrôler les événements de croissance et de différenciation normales.
“Alors qu’un organisme se développe à partir d’un seul œuf fécondé pour former tous les différents types de tissus, ces oncogènes, y compris Src, ont évolué pour contrôler ces événements normaux”, a déclaré Erik Lundquist, professeur de biosciences moléculaires et vice-chancelier associé pour la recherche à l’Université de Kansas.
“Pour comprendre ce que font ces oncogènes dans le cancer, il est important de comprendre ce qu’ils font au cours du développement normal lorsqu’ils ne sont pas défectueux. Lorsque Src subit une mutation qui le rend défectueux, il devient un oncogène. Mais nous” Je regarde ce que fait Src dans un contexte de développement normal.
Maintenant, dans une nouvelle recherche parue dans PLOS UNLundquist et ses collègues de son laboratoire de la KU ont ajouté de nouvelles spécificités au rôle que joue Src dans notre biologie, montrant que le gène est nécessaire au développement sain du système nerveux.
Le travail reposait sur un organisme modèle appelé C. elegans, un ver nématode dont le gène Src est très similaire à celui des humains, mais appelé SRC-1.
“Ce qui est amusant, c’est qu’au moment où les humains et ce ver ont eu pour la dernière fois un ancêtre commun, il y a environ 600 millions d’années, la plupart des fonctions de la protéine Src avaient déjà été élaborées chez cet ancêtre commun”, a déclaré Lundquist. “Ce que nous étudions sur la protéine SRC-1 dans cet organisme modèle, le ver nématode, sera pertinent pour ce qu’il fait dans la croissance et le développement humains et donc dans la pathogenèse humaine et le cancer.”
En utilisant la technologie d’édition de gènes CRISPR dans le laboratoire de Lundquist pour supprimer entièrement la fonction du gène SRC-1 chez les nématodes, les chercheurs de la KU ont montré que le gène joue un rôle clé dans le développement du système nerveux en guidant les axones.
“Au fur et à mesure que le système nerveux se développe, des neurones naissent et doivent élaborer ces structures appelées axones”, a déclaré Lundquist. “Les axones constituent le câblage électrique du système nerveux. La protéine SRC-1 est impliquée dans le développement normal de ces axones.
“Par exemple, dans un contexte humain, si vous avez un motoneurone né dans votre moelle épinière, comment l’axone parvient-il jusqu’au bout de votre doigt jusqu’à un muscle plutôt que jusqu’à votre estomac jusqu’à un muscle ? C’est ce qu’on appelle le guidage axonal. Le SCR-1 la protéine est un acteur clé dans le guidage des axones, et cet article le montre. »
Les collaborateurs de Lundquist à la KU étaient Snehal Mahadik, assistant de recherche diplômé, et Emily Burt, ancienne étudiante de premier cycle.
“Snehal était initialement une étudiante diplômée de notre laboratoire, elle a effectué le travail et a obtenu son doctorat il y a quelques années”, a déclaré Lundquist. “Elle a également travaillé avec une étudiante de premier cycle dans le laboratoire qui est également auteur de l’article : Emily, qui a aidé à réaliser de nombreuses expériences et était responsable de certaines analyses. Snehal a réalisé l’édition du génome, mais Emily a réalisé la plupart des analyses. expériences environnantes.
L’équipe de KU a établi de nouveaux détails sur la façon dont SRC-1 est impliqué dans la croissance des axones, découvrant que SRC-1 régule une structure cellulaire appelée cône de croissance.
“C’est comme le volant de l’axone qui guide l’axone vers sa cible – soit un motoneurone, soit un autre neurone du système nerveux – pour former une synapse”, a déclaré Lundquist. “Parce que l’axone doit être en place pour qu’une synapse se forme, la protéine SRC-1 agit dans le guidage des axones.”
De plus, l’équipe a résolu le débat scientifique sur la manière dont SRC-1 contribue au guidage des axones dans le cadre du développement normal.
“Il y avait eu quelques divergences dans la littérature sur le rôle de ce gène, et nous avons résolu ce problème en le supprimant entièrement, ce qui est tout à fait définitif”, a déclaré Lundquist. “Il s’avère que la mutation que la plupart des gens utilisaient pour étudier SRC-1 chez les vers n’était pas une perte de fonction du gène. Il s’agissait d’une forme activée du gène, ressemblant davantage à ce que fait un oncogène.”
Lundquist, qui travaille également au KU Cancer Center et au KU Center for Genomics, a déclaré que les oncogènes perdent souvent leur capacité à être régulés par d’autres protéines, conduisant à une activité incontrôlée pouvant provoquer une carcinogenèse.
“La mutation du gène SRC-1 était comme ça”, a-t-il déclaré. “Mais nous avons effectué un knock-out net et précis, garantissant que le gène n’avait aucune fonction potentielle dans l’organisme. Nous avons découvert que le phénotype (son apparence physique) était opposé à la mutation précédente, confirmant que la mutation précédente n’était pas une perte de fonction mais une hyperactivité. forme du gène.”
Ces travaux constituent la première étape du développement de nouvelles thérapies pour les lésions de la moelle épinière et les accidents vasculaires cérébraux, qui entraînent des lésions neuronales et la mort.
“En génétique, il existe souvent des cassettes de molécules qui sont réutilisées lors de différents événements”, a déclaré Lundquist. “Nous étudions et définissons une cassette utilisée par Src pour le guidage des axones. Mais cette même cassette pourrait également être impliquée dans des processus liés à l’oncogenèse et au cancer. Cette compréhension nous donne davantage de cibles pour une intervention thérapeutique.”
Le chercheur de la KU a déclaré que si les scientifiques peuvent comprendre comment Src engage ses effecteurs, cela élargira la cible d’une intervention thérapeutique avec des protéines qui peuvent être spécifiquement modifiées par des composés pharmaceutiques particuliers, peut-être d’une manière qui n’était pas appréciée auparavant.
“C’est là l’importance majeure de la recherche biomédicale : comprendre comment ces protéines interagissent les unes avec les autres dans ce contexte”, a-t-il déclaré. “Il existe également un potentiel de réparation ou d’atténuation des effets d’un accident vasculaire cérébral, d’une hypoxie et de lésions nerveuses après un accident vasculaire cérébral ou une lésion de la moelle épinière. Notre système nerveux central ne se régénère pas bien, donc comprendre comment les neurones se développent normalement pourrait éventuellement nous aider à comprendre comment ils pourraient repousser. “
Plus d’information:
Snehal S. Mahadik et al, SRC-1 contrôle la polarité et la saillie du cône de croissance avec le récepteur UNC-6/Netrin UNC-5 chez Caenorhabditis elegans, PLOS UN (2024). DOI : 10.1371/journal.pone.0295701
Fourni par l’Université du Kansas
Citation: Une étude révèle que les mêmes gènes qui peuvent conduire au cancer guident également la croissance du circuit neuronal (24 juin 2024) récupéré le 24 juin 2024 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.