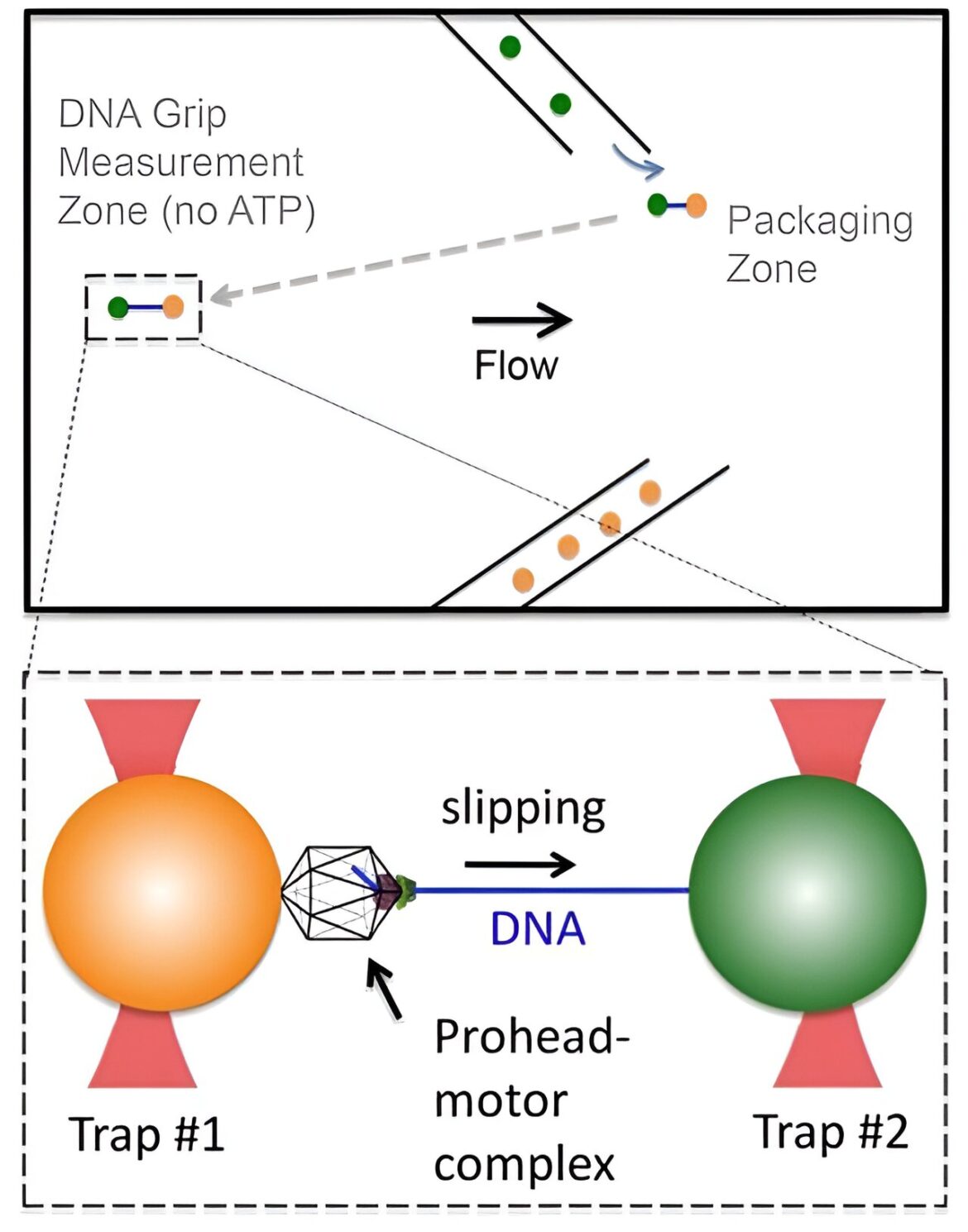
Les complexes d’empaquetage Lambda bloqués avec l’ATP-γS sont attachés par l’extrémité ADN à une microsphère (orange) et piégés avec une pince optique. Cette microsphère est rapprochée d’une deuxième microsphère piégée recouverte d’anticorps qui se lient à la capside (verte). Lorsqu’il est exposé à l’ATP, le moteur conditionne l’ADN. Une fois environ 1,5 à 6 kpb d’ADN (bleu) emballés, le complexe est déplacé (flèche en pointillés) dans une région ne contenant ni aucun nucléotide, ni 0,5 mM d’ATP-γS, d’AMP-PNP ou d’ADP. La longueur de l’ADN à l’extérieur de la capside en fonction du temps est mesurée. Crédit: eLife (2023). DOI : 10.7554/eLife.91647.1
Les chercheurs ont utilisé des « pinces optiques » alimentées par laser pour révéler un mécanisme moteur universel utilisé par les virus pour conditionner leur ADN en particules infectieuses.
La recherche, publiée sous forme de prépublication révisée dans eLife, est décrite par les éditeurs comme une étude fondamentale qui pourrait changer de paradigme pour notre compréhension du fonctionnement des moteurs de l’ADN viral et des rôles précis des protéines individuelles dans le complexe moteur. Ils ajoutent que les expériences fournissent des preuves convaincantes des conclusions de l’étude.
De nombreux virus, y compris ceux qui affectent les humains, comme l’herpèsvirus, utilisent de minuscules moteurs alimentés par une molécule appelée ATP pour conditionner leur matériel génétique dans des coques pré-assemblées appelées procapsides. Comprendre le fonctionnement de ces moteurs est non seulement important pour la conception de médicaments antiviraux, mais met également en lumière les mécanismes moteurs généraux qui s’appliquent à d’autres types de moteurs au sein des cellules.
Les pinces optiques sont une méthode dans laquelle des lasers sont utilisés pour retenir et déplacer des particules submicroscopiques. Ils ont été développés pour la première fois par Arthur Ashkin, qui a ensuite remporté le prix Nobel de physique pour cette innovation en 2018. Ces pinces ont permis des études plus détaillées des moteurs de l’ADN, y compris le rôle des enzymes composantes clés appelées terminases. Cependant, il reste beaucoup à comprendre sur la nature des interactions moteur-ADN, comme la manière dont les moteurs saisissent l’ADN et ce qui provoque une pause ou un glissement du moteur.
“Des études ont suggéré que la liaison de l’ATP amène les moteurs de l’ADN à saisir l’ADN et que la décomposition de l’ATP en ADP permet sa libération”, explique le premier auteur Brandon Rawson, étudiant au département de physique de l’Université de Californie à San Diego, aux États-Unis.
“Pour sonder cette interaction plus en détail, nous avons précédemment développé une méthode de pince optique modifiée pour étudier le moteur d’un virus bactérien appelé phage T4, qui contient une protéine motrice appelée TerL, et avons montré que l’ATP non seulement incite TerL à saisir l’ADN, mais contrôle également l’ADN. ” La friction entre le moteur et l’ADN pendant le glissement, également. Dans cette étude, nous avons étendu cela pour examiner un complexe moteur contenant TerL plus une protéine composante moins comprise TerS pour comprendre comment ils travaillent ensemble pour contrôler l’empaquetage du génome viral. ”
L’équipe a étudié le moteur d’empaquetage du génome contenant à la fois TerL et TerS d’un virus bactérien appelé phage lambda, qui utilise un processus d’empaquetage similaire à celui de l’herpèsvirus humain. Lorsque ces virus se répliquent, ils produisent plusieurs copies liées de leur génome, qui doivent ensuite être découpées et chaque génome emballé séparément.
Une façon dont les virus y parviennent est appelée emballage du génome en « longueur unitaire ». En bref, la sous-unité TerS initie l’empaquetage lorsqu’elle rencontre un site spécifique appelé cos dans le génome. TerL coupe ensuite le génome et entraîne l’empaquetage (translocation d’ADN) dans la coque de la procapside jusqu’à ce qu’un autre site cos soit rencontré. À ce stade, le moteur s’arrête et TerL coupe l’ADN pour libérer la particule emballée. Bien que le rôle de TerL soit connu dans les étapes de translocation et de terminaison, il était moins clair si TerS avait joué un rôle pendant la translocation.
En étudiant TerL et TerS en tant que moteurs fonctionnels dans la même expérience, l’équipe a remarqué qu’en présence de TerS et de TerL, il y avait une saisie d’ADN beaucoup plus fréquente et une friction moteur-ADN élevée, même en l’absence d’ATP disponible. Cela n’a pas été observé lors d’expériences précédentes lorsque seul TerL est présent.
Lorsque l’ATP ou l’ADP étaient ajoutés, cela augmentait encore la préhension et la friction, indiquant deux mécanismes d’interaction moteur-ADN : dépendant des nucléotides et indépendant des nucléotides. La préhension de l’ADN était la plus forte lorsque l’ATP était lié au moteur, plus faible lorsque l’ADP était attaché et la plus faible sans aucun nucléotide lié.
Dans des études précédentes avec le phage T4, l’équipe avait également découvert une « pince d’extrémité » d’ADN qui empêche la molécule d’ADN entière de glisser vers l’arrière hors de la procapside pendant l’emballage. Dans cette étude, ils ont constaté que le phage lambda partage ce mécanisme. Si l’ADN glisse au point de tomber complètement, il est attrapé par son extrémité et empêché de se détacher de la procapside, même en l’absence d’ATP.
“Nos études actuelles, s’appuyant sur des études sur des virus qui utilisent différents mécanismes d’empaquetage, révèlent des caractéristiques universelles des moteurs terminase et suggèrent un rôle pour la sous-unité TerS conservée lors de l’empaquetage de l’ADN”, explique l’auteur principal Douglas Smith, professeur de physique à l’UC San Diego.
“Ces résultats soutiennent un mécanisme universel conservé pour la fonction motrice de la terminase, véhiculé par la protéine TerL, mais mettent également en évidence une différence clé entre les systèmes : une prise d’ADN beaucoup plus fréquente dans les moteurs contenant du TerS, ce qui suggère que TerS fonctionne comme une pince coulissante. Le mécanisme de serrage d’extrémité augmente également l’efficacité de l’emballage et est probablement équivalent au complexe formé au début de l’emballage, ce qui implique que notre méthode pourrait fournir une avenue pour explorer les facteurs affectant la stabilité de ce complexe.
Plus d’information:
Brandon Rawson et al, Régulation des interactions moteur-ADN du phage lambda packaging : préhension et friction indépendantes et dépendantes des nucléotides, eLife (2023). DOI : 10.7554/eLife.91647.1
Informations sur la revue :
eLife
Citation: Des « pinces » alimentées par laser révèlent le mécanisme universel utilisé par les virus pour emballer l’ADN (21 novembre 2023) récupéré le 21 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.