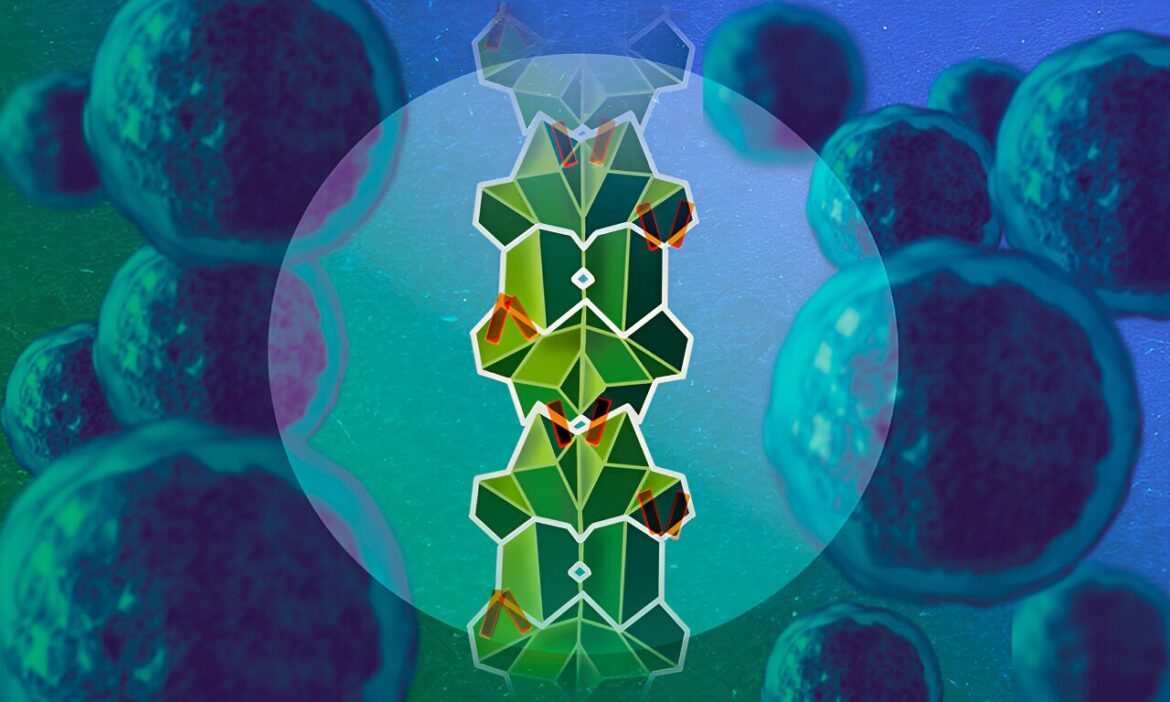
Une métaphore visuelle représentant la protéine non structurée RAI2 (certaines de celle-ci sont visibles en orange), car elle désactive la protéine CtBP (verte) favorisant le cancer en empilant ses molécules dans un polymère allongé qui forme des agrégats dans les cellules. Ce processus peut jouer un rôle dans la façon dont le cancer évolue jusqu’à devenir résistant au traitement. Crédit : Isabel Romero Calvo/EMBL
Chaque seconde de notre vie, les cellules de notre corps se développent et se divisent pour garantir notre santé. Cependant, ce processus a un côté sombre : si la croissance et les divisions cellulaires deviennent excessives, cela peut provoquer un cancer. Pour maintenir un équilibre sûr, nos cellules sont équipées de plusieurs mécanismes moléculaires pour limiter leur propre croissance et division.
Le groupe Wilmanns de l'EMBL Hambourg, en collaboration avec des groupes de recherche du Centre de médecine expérimentale de l'Institut de biologie tumorale et de la clinique Martini du centre médical universitaire de Hambourg-Eppendorf (UKE), ainsi que de l'Institut Leibniz sur le vieillissement-Institut Fritz Lipmann, a a révélé un nouveau mécanisme par lequel les cellules neutralisent l'une des principales protéines favorisant le cancer en empilant et en fixant ses molécules en tas. Les résultats mettent en lumière la façon dont le cancer de la prostate évolue du stade traitable au stade agressif et résistant au traitement.
L'ouvrage est publié dans la revue Communications naturelles.
Un méchant et un héros
Leur découverte, comme un bon roman, a un méchant et un héros.
Le « méchant » dans cette histoire est un groupe de protéines, appelées CtBP (C-terminal Binding Proteins), qui régulent l'activité de plusieurs gènes impliqués dans la croissance et la division cellulaire. Dans diverses études, il a été démontré que les CtBP participaient à la promotion du développement du cancer.
Mais la cellule a ses moyens d’exploiter le méchant – c’est là qu’intervient le « héros » : la protéine RAI2 (Retinoïc Acid-Induced 2). RAI2 n'a été découvert que récemment et, même s'il est présent dans la cellule en petites quantités, il a été démontré qu'il joue un rôle dans la prévention des métastases cancéreuses. Cependant, jusqu’à présent, on ne savait pas exactement comment y parvenir.
Les scientifiques ont découvert que RAI2 possède une capacité remarquable à saisir les molécules de CtBP et à les empiler dans un processus appelé polymérisation. À mesure qu’elles s’accumulent, les molécules CtBP forment des agrégats allongés dans les lignées cellulaires cancéreuses, décrits comme des « foyers nucléaires ». Piégé et empilé par RAI2 dans l'ensemble, CtBP, le méchant, devient inactif.
“La polymérisation est devenue un domaine d'intérêt émergent dans les sciences de la vie, mais à notre connaissance, elle n'a pas été décrite jusqu'à présent dans le contexte d'une interférence avec la progression du cancer”, a déclaré Matthias Wilmanns, chef de groupe à l'EMBL Hambourg. “La découverte de ce nouveau mécanisme d'inhibition puissante d'une cible pourrait ouvrir de nouvelles directions thérapeutiques anticancéreuses, telles que le développement de petites molécules présentant un potentiel de polymérisation de cibles cancéreuses.”
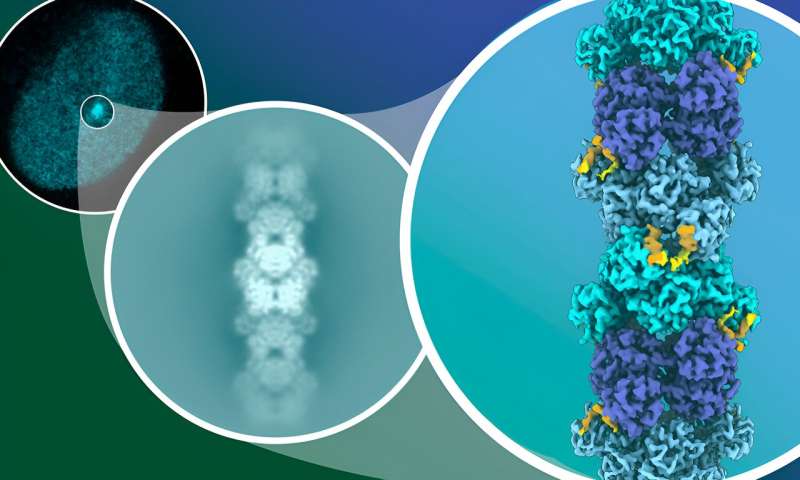
Les scientifiques ont observé les polymères CtBP-RAI2 à différentes échelles : au niveau cellulaire, sous forme d'agrégats, ou « foyers », dans le noyau (en haut à gauche) et au niveau moléculaire sous la forme d'un empilement de molécules capturées par microscopie cryoélectronique (au milieu). ). Ce dernier leur a permis de créer un modèle structurel détaillé (à droite). Crédit : Isabel Romero Calvo/EMBL
Un héros invisible
Pour les biologistes structuralistes comme le groupe Wilmanns, RAI2, le héros, est essentiellement une protéine invisible. Alors que la majorité des protéines, comme l'origami, se replient en structures 3D, RAI2 ressemble plutôt à une bande flexible qui ne cesse de changer de forme. Capturer une protéine aussi bancale en haute résolution est impossible avec les techniques de biologie structurale actuellement disponibles.
“Vous pourriez comparer cela à essayer de prendre une photo d'un objet en mouvement la nuit : vous obtiendrez une image floue”, a déclaré Wilmanns.
Dans cette étude, les seules parties de RAI2 qui pouvaient être visualisées dans le modèle moléculaire étaient les seules parties qui resteraient immobiles : les fragments « collants » à travers lesquels RAI2 lie les CtBP. Chaque molécule RAI2 possède deux de ces fragments (représentés en orange sur les images), qui lui permettent, à la manière d'un ruban adhésif, de coller deux molécules CtBP ensemble.
“Les protéines bancales comme RAI2 sont difficiles à utiliser, donc ce projet a demandé beaucoup de travail acharné, de concentration, de détermination et une attitude de 'ne jamais abandonner'”, a déclaré Nishit Goradia, ancien postdoctorant au sein du groupe Wilmanns, actuellement chercheur à l'UKE.
“Nous avons révélé que RAI2 est un véritable cheval noir. Comme d'autres protéines bancales, elle est assez peu étudiée, mais elle possède un véritable potentiel pour inactiver les protéines favorisant le cancer. Pour moi, cela a été un projet déterminant pour ma carrière et j'en suis fier. de cette réalisation.”
Protéine bancale dans le cancer de la prostate
Pour vérifier si le nouveau mécanisme joue un rôle dans le cancer humain, les scientifiques ont analysé, outre les lignées cellulaires cancéreuses, des échantillons de cancer provenant d'une cohorte diversifiée de plus de 100 patients du centre de cancérologie universitaire de Hambourg et de la clinique Martini de l'UKE. Ils se sont concentrés sur le cancer de la prostate, le deuxième type de cancer le plus répandu chez les hommes et la troisième cause de décès par cancer.
Au cours du traitement, le cancer de la prostate peut développer une résistance au traitement, entraînant un très mauvais pronostic pour les patients. Cependant, on ne comprend pas encore complètement pourquoi certaines formes de cancer de la prostate se transforment en certains sous-types très agressifs, et d'autres non. RAI2 pourrait jouer ici un rôle clé.
Dans les lignées de cellules tumorales et dans les échantillons de patients, les scientifiques ont constaté que les niveaux de RAI2 étaient fortement réduits dans les types de cancer de la prostate les plus graves et les plus résistants au traitement. Lors d'analyses in vitro, ils ont constaté que la perte de RAI2 favorise les processus cellulaires pouvant conduire à une résistance à certains types de traitements.
“Même si nous ne sommes pas encore en mesure d'utiliser ce résultat à des fins thérapeutiques, il s'agit d'une étape décisive vers une meilleure compréhension de la manière dont se développe un sous-type très agressif de cancer de la prostate”, a déclaré Gunhild von Amsberg, professeur d'uro-oncologie au Centre universitaire de lutte contre le cancer de Hambourg et la Clinique Martini. “Une prochaine étape importante consistera à transférer nos résultats à la clinique et à identifier ainsi à un stade précoce les patients susceptibles d'être à risque.”
Bien que l’analyse se soit concentrée sur le cancer de la prostate, les scientifiques soupçonnent que l’importance de leur découverte pourrait également s’appliquer à d’autres cancers.
La biologie moléculaire rencontre les cliniques
L'étude fait partie de la collaboration de longue date entre l'EMBL et l'UKE et met en valeur les avantages de la combinaison des approches scientifiques complémentaires des deux institutions. Alors que l'UKE mène un large éventail de projets médicaux, en partie basés sur les données des patients, l'EMBL apporte son expertise dans l'étude de la vie à différentes échelles biologiques, notamment en étudiant les mécanismes de la maladie aux niveaux moléculaire et cellulaire.
“Ce travail démontre les perspectives futures de collaboration entre la biologie moléculaire et les cliniques pour débloquer la recherche” des molécules aux patients “”, a déclaré Wilmanns.
Plus d'information:
Nishit Goradia et al, Inactivation du corépresseur principal par polymérisation multivalente induite par SLiM médiée par le suppresseur d'oncogène RAI2, Communications naturelles (2024). DOI : 10.1038/s41467-024-49488-3
Fourni par le Laboratoire européen de biologie moléculaire
Citation: Des scientifiques révèlent comment une protéine non structurée piège les molécules favorisant le cancer (19 juin 2024) récupéré le 19 juin 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.