Crédit: Cellule (2023). DOI : 10.1016/j.cell.2023.11.029
La maladie d'Alzheimer frappe une grande famille colombienne depuis des générations, tuant la moitié de ses membres dans la fleur de l'âge. Mais un membre de cette famille a échappé à ce qui semblait être le destin : bien qu’elle ait hérité du défaut génétique qui a amené ses proches à développer une démence dans la quarantaine, elle est restée en bonne santé cognitive jusqu’à 70 ans.
Les chercheurs de la faculté de médecine de l’université de Washington à Saint-Louis pensent désormais savoir pourquoi. Une étude précédente avait rapporté que contrairement à ses proches, la femme était porteuse de deux copies d'une variante rare du gène APOE connue sous le nom de mutation de Christchurch.
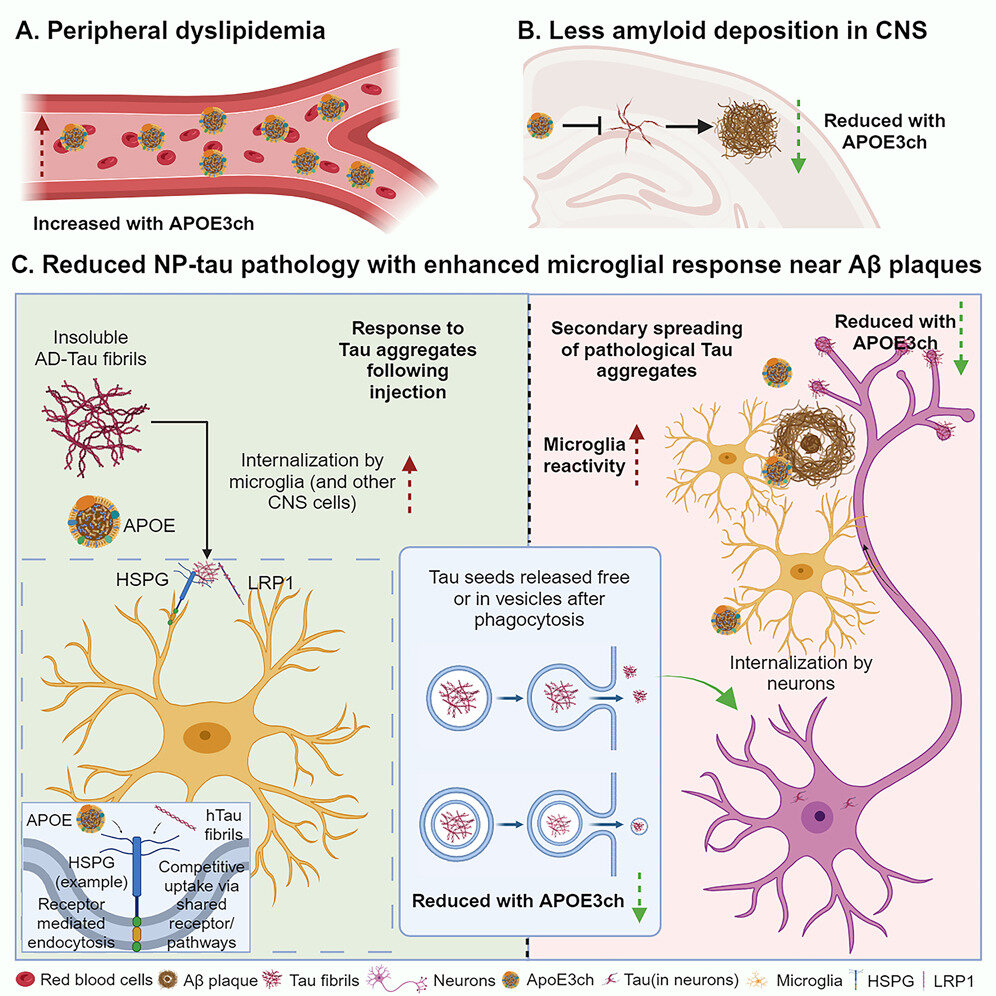
Dans cette étude, les chercheurs ont utilisé des souris génétiquement modifiées pour montrer que la mutation de Christchurch rompt le lien entre la phase précoce de la maladie d'Alzheimer, lorsqu'une protéine appelée bêta-amyloïde s'accumule dans le cerveau, et la phase tardive, lorsqu'une autre protéine appelée tau s'accumule et un déclin cognitif s’installe. Ainsi, la femme est restée mentalement alerte pendant des décennies, même si son cerveau se remplissait d’énormes quantités d’amyloïde. Les résultats, publiés le 11 décembre dans la revue Cellulesuggèrent une nouvelle approche pour prévenir la démence d'Alzheimer.
“Tout facteur de protection est très intéressant, car il nous donne de nouveaux indices sur le fonctionnement de la maladie”, a déclaré l'auteur principal David M. Holtzman, MD, professeur distingué de neurologie Barbara Burton et Reuben M. Morriss III.
“À mesure que les gens vieillissent, beaucoup commencent à développer une certaine accumulation d'amyloïde dans leur cerveau. Au début, ils restent normaux sur le plan cognitif. Cependant, après de nombreuses années, le dépôt d'amyloïde commence à conduire à l'accumulation de protéine tau. Lorsque cela se produit, des troubles cognitifs se produisent rapidement. Si nous pouvons trouver un moyen d'imiter les effets de la mutation APOE Christchurch, nous pourrons peut-être empêcher les personnes qui sont déjà sur le chemin de la démence d'Alzheimer de continuer sur cette voie.
La maladie d'Alzheimer se développe sur une période d'environ 30 ans. Les deux premières décennies environ sont silencieuses ; l'amyloïde s'accumule lentement dans le cerveau sans provoquer d'effets néfastes. Cependant, lorsque les niveaux d’amyloïde atteignent un point critique, ils déclenchent la phase deux, qui implique de multiples processus destructeurs interdépendants : une protéine appelée tau forme des enchevêtrements qui se propagent dans le cerveau ; le métabolisme cérébral ralentit et le cerveau commence à rétrécir ; et les gens commencent à éprouver des problèmes de mémoire et de réflexion. La maladie suit le même schéma chez les personnes atteintes de formes génétiques et non génétiques d'Alzheimer.
Les familles colombiennes sont porteuses d’une mutation dans un gène appelé préséniline-1 qui provoque une accumulation beaucoup trop importante d’amyloïde dans leur cerveau à partir de la vingtaine. Les personnes porteuses de la mutation accumulent l’amyloïde si rapidement qu’elles atteignent le point de bascule et commencent à montrer des signes de déclin cognitif à l’âge mûr. Une rare exception est une femme qui avait plus d'amyloïde dans son cerveau à 70 ans que ses proches dans la quarantaine, mais seulement des signes très minimes de lésions cérébrales et de troubles cognitifs.
“L'une des plus grandes questions sans réponse dans le domaine de la maladie d'Alzheimer est de savoir pourquoi l'accumulation d'amyloïde conduit à une pathologie tau”, a déclaré Holtzman. “Cette femme était très, très inhabituelle dans la mesure où elle souffrait d'une pathologie amyloïde mais pas beaucoup de pathologie tau et seulement de très légers symptômes cognitifs apparus tardivement. Cela nous a suggéré qu'elle pourrait détenir des indices sur ce lien entre l'amyloïde et la tau.”
Une étude de 2019 avait révélé qu'en plus d'une mutation de la préséniline-1, la femme était également porteuse de la mutation de Christchurch dans les deux copies de son gène APOE, un autre gène associé à la maladie d'Alzheimer. Mais avec une seule personne au monde connue pour présenter cette combinaison particulière de mutations génétiques, il n'y avait pas suffisamment de données pour prouver que la mutation de Christchurch était responsable de sa remarquable résistance à la maladie d'Alzheimer et qu'il ne s'agissait pas d'une simple découverte fortuite.
Pour résoudre cette énigme, Holtzman et le premier auteur Yun Chen, un étudiant diplômé, se sont tournés vers des souris génétiquement modifiées. Ils ont pris des souris génétiquement prédisposées à surproduire de l’amyloïde et les ont modifiées pour qu’elles portent le gène humain APOE avec la mutation de Christchurch. Ensuite, ils ont injecté un tout petit peu de tau humain dans le cerveau de souris. Normalement, l’introduction de la tau dans des cerveaux déjà remplis de graines amyloïdes est un processus pathologique au cours duquel la tau se rassemble en agrégats au site d’injection, suivi de la propagation de ces agrégats à d’autres parties du cerveau.
Ce n’était pas le cas chez les souris porteuses de la mutation Christchurch. Tout comme la femme colombienne, les souris ont développé une pathologie mineure du tau malgré de vastes plaques amyloïdes. Les chercheurs ont découvert que la principale différence résidait dans les niveaux d’activité des microglies, les cellules d’élimination des déchets du cerveau. Les microglies ont tendance à se regrouper autour des plaques amyloïdes. Chez les souris porteuses de la mutation APOE Christchurch, les microglies entourant les plaques amyloïdes étaient ravivées et hyperefficaces pour consommer et éliminer les agrégats de tau.
“Ces microglies absorbent la protéine Tau et la dégradent avant que la pathologie de la protéine Tau ne puisse se propager efficacement à la cellule suivante”, a déclaré Holtzman. “Cela a bloqué une grande partie du processus en aval ; sans pathologie tau, vous n'obtenez pas de neurodégénérescence, d'atrophie et de problèmes cognitifs. Si nous pouvons imiter l'effet de la mutation, nous pourrons peut-être rendre l'accumulation d'amyloïde inoffensive, ou du moins beaucoup moins nocifs et protègent les gens contre le développement de déficiences cognitives.
Plus d'information:
Yun Chen et al, APOE3ch modifie la réponse microgliale et supprime l'ensemencement et la propagation de la protéine Tau induite par l'Aβ, Cellule (2023). DOI : 10.1016/j.cell.2023.11.029
Cellule
Fourni par la faculté de médecine de l'Université de Washington
Citation: Les indices pour prévenir la maladie d'Alzheimer proviennent d'un patient qui a échappé à la maladie, malgré la génétique (11 décembre 2023) récupéré le 11 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.