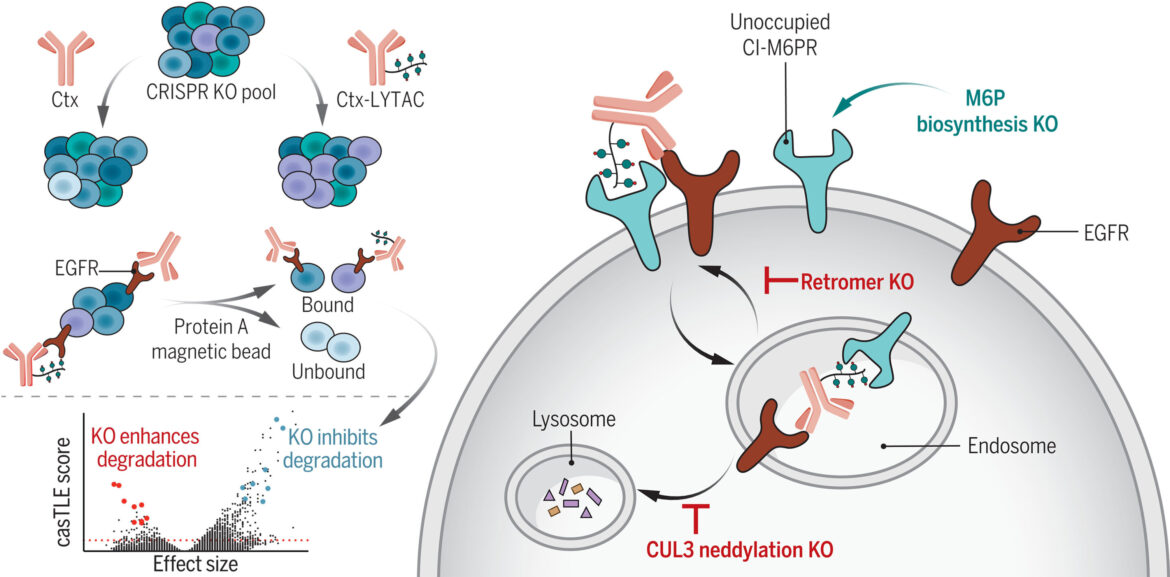
Identifier les déterminants cellulaires de la dégradation des protéines membranaires médiée par LYTAC. Un criblage CRISPR à l’échelle du génome a été réalisé pour identifier les facteurs régulant la dégradation du récepteur du facteur de croissance épidermique (EGFR) médiée par LYTAC via le tri cellulaire magnétique. L’inactivation (KO) du complexe rétromère a entraîné une réduction du recyclage du complexe cible LYTAC. La neddylation CUL3 était essentielle au trafic et à la dégradation des lysosomals. La perturbation de la voie de biosynthèse du M6P a entraîné une augmentation du CI-M6PR inoccupé à la surface cellulaire, améliorant ainsi l’internalisation du récepteur LYTAC. Ctx, cétuximab. Crédit: Science (2023). DOI : 10.1126/science.adf6249
Lorsqu’il cible des protéines problématiques impliquées dans l’apparition ou la propagation d’une maladie, un médicament obstrue souvent le site actif d’une protéine, la rendant ainsi incapable de fonctionner et de faire des ravages. De nouvelles stratégies pour traiter ces protéines peuvent envoyer ces protéines vers différents types de machines de dégradation des protéines cellulaires, telles que les lysosomes d’une cellule, qui agissent comme un broyeur de protéines.
Dans une nouvelle étude publiée dans Science Le 20 octobre, des chimistes de Stanford ont découvert comment fonctionne l’une des voies menant à cette « déchiqueteuse de bois » protéique. Ce faisant, ils ont ouvert la porte à de nouveaux traitements pour les troubles liés à l’âge, les maladies auto-immunes et les cancers résistants aux traitements. Ces résultats pourraient également améliorer le traitement des troubles du stockage lysosomal, qui sont des affections rares mais souvent graves affectant principalement les bébés et les enfants.
“Comprendre exactement comment les protéines sont transportées vers les lysosomes pour y être décomposées peut nous aider à exploiter le pouvoir inné d’une cellule pour se débarrasser des protéines qui causent tant de dommages au corps humain”, ont déclaré Carolyn Bertozzi, de l’étude Anne T. et Robert M. Professeur de basse à la Faculté des sciences humaines et directrice de la famille Baker de Sarafan ChEM-H. “Le travail effectué ici est un aperçu clair d’un processus intracellulaire généralement opaque, et il met en lumière un nouveau monde de découverte possible de médicaments.”
“La capacité de comprendre la biologie de ce processus signifie que nous pouvons utiliser la biologie inhérente qui existe déjà et l’exploiter pour traiter la maladie”, a déclaré Steven Banik, professeur adjoint de chimie à l’École des sciences humaines. “Ces informations offrent une fenêtre unique sur un nouveau type de biologie que nous n’avions pas vraiment compris auparavant.”
Empêcher les protéines de devenir indésirables
Même si les protéines font souvent du bien à l’organisme, comme nous aider à digérer nos aliments ou à réparer les muscles déchirés, elles peuvent aussi être destructrices. Dans le cancer, par exemple, les protéines peuvent soit faire partie de la tumeur et/ou permettre sa croissance incontrôlée, provoquer des maladies dévastatrices comme la maladie d’Alzheimer et s’accumuler dans le cœur pour affecter la façon dont il pompe le sang vers le reste du corps.
Pour arrêter les protéines indésirables, des médicaments peuvent être déployés pour bloquer le site actif d’une protéine et ainsi l’empêcher d’interagir avec une cellule, ce qui a été la norme de la recherche thérapeutique pendant des décennies. Puis, il y a 20 ans, des chimères ciblant la protéolyse (PROTAC) ont fait leur apparition, capables d’attaquer des protéines mal agissantes déjà présentes à l’intérieur d’une cellule et de les envoyer se décomposer dans le lysosome.
Les PROTAC font actuellement l’objet d’essais cliniques et ont montré leur efficacité dans le traitement du cancer. Mais ils ne peuvent cibler une protéine que si elle se trouve à l’intérieur de la cellule, soit seulement 60 % du temps. En 2020, les chercheurs de Stanford ChEM-H ont découvert un moyen d’atteindre les 40 % restants de ces protéines grâce à des chimères ciblant les lysosomes (LYTAC), qui peuvent identifier et marquer les protéines qui traînent autour de la cellule, ou sur la membrane d’une cellule, pour les détruire. .
Ces découvertes ont donné le coup d’envoi à une nouvelle classe de recherche et de thérapies, mais le fonctionnement exact du processus n’était pas clair. Les chercheurs ont également remarqué qu’il était difficile de prédire quand les LYTAC connaîtraient un grand succès ou ne fonctionneraient pas comme prévu.
De nouvelles cibles thérapeutiques
Dans ce travail, Green Ahn, Ph.D., alors étudiant diplômé de Stanford et maintenant chercheur postdoctoral à l’Institut de conception de protéines de l’Université de Washington, et auteur principal de l’étude, a utilisé un écran génétique CRISPR pour identifier et caractériser les cellules. des composants qui modulent la façon dont les LYTAC dégradent les protéines.
Grâce à ce dépistage, l’équipe a identifié un lien entre le niveau de culline neddylée 3 (CUL3) – une protéine qui joue un rôle d’entretien dans la dégradation des protéines cellulaires – et l’efficacité de LYTAC. Le lien exact n’est pas encore clair, mais plus le CUL3 était neddylé, plus les LYTAC étaient efficaces.
La mesure du niveau de CUL3 neddylé pourrait être un test destiné à déterminer quels patients sont les plus susceptibles de répondre au traitement LYTAC. Il s’agit d’une découverte surprenante, a déclaré Bertozzi, car aucune recherche antérieure n’avait mis en évidence cette corrélation auparavant.
Ils ont également identifié des protéines qui empêchent les LYTAC de faire leur travail. Les LYTAC fonctionnent en se liant à certains récepteurs situés à l’extérieur de la cellule, qu’ils utilisent pour transporter les mauvaises protéines vers les lysosomes en vue de leur dégradation. Cependant, les chercheurs ont constaté que les protéines portant des mannose 6-phosphates (M6P), des sucres qui décorent les protéines destinées aux lysosomes, prendront place sur ces récepteurs, ce qui signifie que les LYTAC n’auront nulle part où se lier. En mettant un frein à la biosynthèse du M6P, une fraction accrue de récepteurs inoccupés s’est formée à la surface des cellules, qui pourraient être détournés par les LYTAC.
Nouvelle biologie, nouvelles voies de traitement des maladies
En plus d’aider à développer les LYTAC en thérapies plus efficaces, ces découvertes pourraient également conduire à de nouveaux traitements plus efficaces pour les troubles liés à la pénurie de lysosomes, des conditions génétiques dans lesquelles le corps n’a pas assez d’enzymes dans les lysosomes pour fonctionner correctement. Cela peut provoquer une accumulation toxique de graisses, de sucres et d’autres substances nocives, pouvant entraîner des lésions cardiaques, cérébrales, cutanées et squelettiques. Un traitement courant est la thérapie enzymatique substitutive, qui utilise des voies similaires à celles des LYTAC pour se rendre aux lysosomes où ils peuvent opérer. Comprendre comment et pourquoi les LYTAC fonctionnent signifie que ces enzymes pourraient être administrées plus efficacement.
Les chercheurs ont comparé ce travail à une découverte importante sur le fonctionnement exact du médicament thalidomide. Il a été initialement prescrit dans les années 1950 contre les nausées matinales chez les femmes enceintes, principalement au Royaume-Uni, mais a été retiré du marché en 1961 lorsqu’il a été associé à de graves malformations congénitales. Cependant, dans les années 1990, il s’est avéré efficace dans le traitement du myélome multiple. En 2010, les chercheurs ont compris comment : en dégradant les protéines, une observation qui a largement contribué au domaine croissant de la recherche PROTAC.
“L’évolution du LYTAC correspond à l’histoire de la thalidomide et des PROTAC il y a 15 ans”, a déclaré Bertozzi. “Nous apprenons la biologie humaine qui n’était pas connue auparavant.”
Plus d’information:
Green Ahn et al, Élucider les déterminants cellulaires de la dégradation ciblée des protéines membranaires par des chimères ciblant les lysosomes, Science (2023). DOI : 10.1126/science.adf6249
Fourni par l’Université de Stanford
Citation: Ouvrir des voies pour décomposer les protéines problématiques présente de nouvelles opportunités de traitement (25 octobre 2023) récupéré le 26 octobre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.