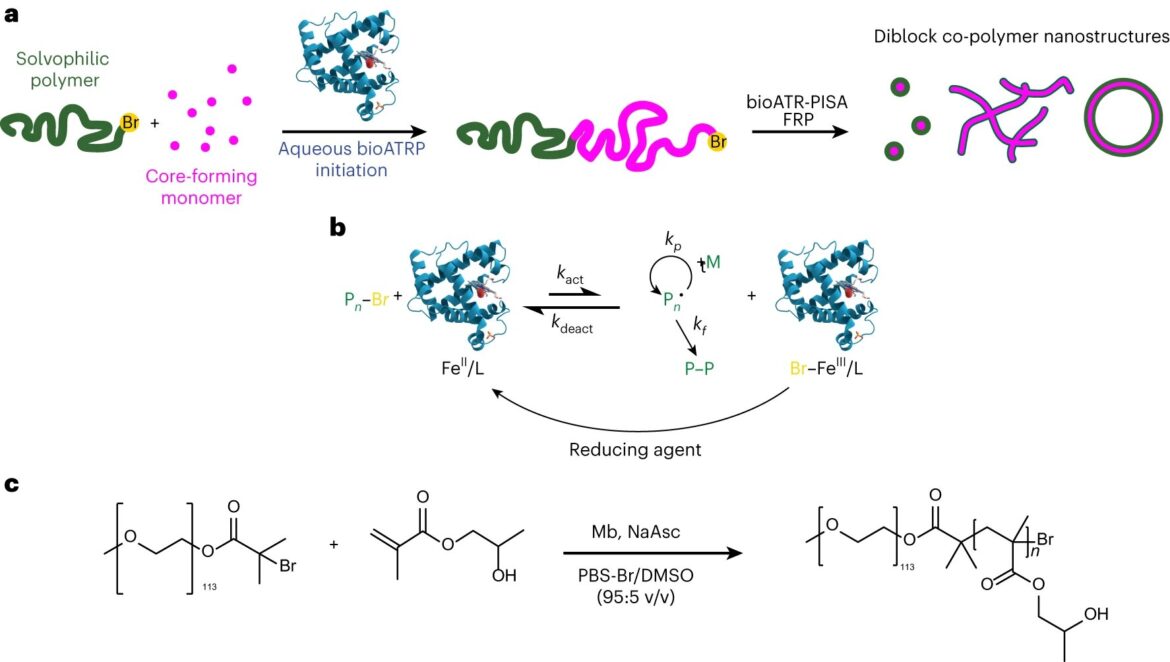
La réaction bioPISA du HPMA initiée par mPEG-Br pour produire des copolymères séquencés amphiphiles. a, Schéma du procédé bioPISA qui produit diverses structures auto-assemblées en solutions aqueuses, à l'aide de bioATRP qui évolue ensuite en polymérisation radicalaire (FRP). b, Mécanisme du bioATRP médié par Mb. c, Schéma réactionnel de bioPISA par extension de chaîne d'un macroinitiateur PEG-BiB avec HPMA en solution aqueuse, conduisant au copolymère dibloc amphiphile mPEG-b-PHPMA. Crédit: Chimie naturelle (2023). DOI : 10.1038/s41557-023-01391-y
Une étude publiée dans Chimie naturelle révèle un bond remarquable dans la synthèse de cellules artificielles à l'aide de matériaux synthétiques, réalisé par une équipe internationale dirigée par le Dr Andrea Belluati, le professeur Nico Bruns (tous deux TU Darmstadt) et le Dr Sètuhn Jimaja (Université de Fribourg).
Ces cellules, fabriquées grâce à un processus appelé auto-assemblage induit par polymérisation biocatalytique (bioPISA), représentent une avancée significative dans le domaine de la biologie synthétique.
Les cellules artificielles sont des structures microscopiques qui imitent les propriétés des cellules vivantes. Ils représentent d’importants microréacteurs pour améliorer les réactions chimiques et pour l’ingénierie des systèmes moléculaires, agissent comme hôtes pour les voies de la biologie synthétique et constituent des outils importants pour étudier l’origine de la vie.
L'équipe a développé une synthèse enzymatique de microcapsules polymères et les a utilisées pour encapsuler le contenu soluble (c'est-à-dire le cytosol) des cellules bactériennes, créant ainsi des cellules artificielles capables de produire une gamme de protéines à l'intérieur, y compris une protéine fluorescente, la la protéine structurale actine pour créer une structure semblable à un cytosquelette et l'enzyme phosphatase alcaline pour imiter le processus de biominéralisation trouvé dans les os humains.
L’expression de protéines imite non seulement l’une des propriétés fondamentales des cellules vivantes, mais met également en valeur le potentiel de ces cellules artificielles dans diverses applications, depuis l’administration de médicaments jusqu’à l’ingénierie tissulaire.
“Notre étude comble une lacune cruciale dans la biologie synthétique, en fusionnant le monde des matériaux synthétiques avec des processus enzymatiques pour créer des cellules artificielles complexes, tout comme de vraies cellules”, explique Belluati. “Cela ouvre de nouveaux horizons dans la création de cellules imitatrices qui ne sont pas seulement structurellement similaires aux cellules biologiques, mais également fonctionnellement compétentes.”
Bruns ajoute : « Les polymérisations radicalaires enzymatiques sont la clé de la création de ces cellules artificielles. Les enzymes synthétisent des polymères qui s'auto-assemblent pendant la polymérisation en capsules polymères de taille nano et micro. Il s'agit d'un moyen très simple mais efficace de préparer les cellules artificielles. Dans les travaux futurs, nous visons à utiliser des protéines exprimées dans les cellules artificielles pour catalyser d’autres polymérisations, imitant ainsi la croissance et la réplication des cellules naturelles. »
Plus d'information:
Andrea Belluati et al, Synthèse de cellules artificielles utilisant l'auto-assemblage induit par polymérisation biocatalytique, Chimie naturelle (2023). DOI : 10.1038/s41557-023-01391-y
Fourni par la Technische Universitat Darmstadt
Citation: Percée dans la synthèse de cellules artificielles (5 décembre 2023) récupéré le 5 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.