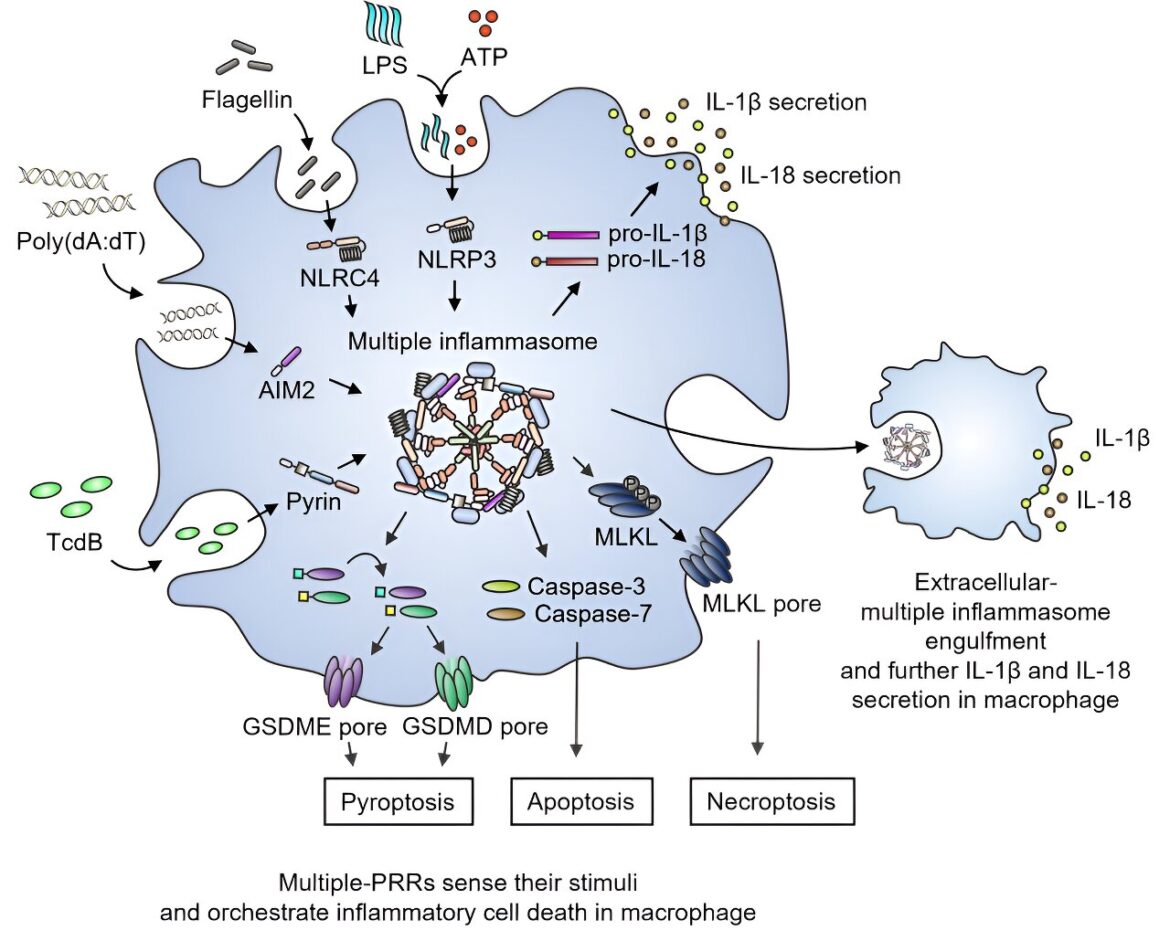
La formation de panoptosomes et l’apoptose inflammatoire suite à l’injection de quatre modèles liés à l’agent pathogène. Crédit: Immunologie cellulaire et moléculaire (2023). DOI : 10.1038/s41423-023-01107-9
Une équipe de chercheurs affiliés à l’UNIST ont découvert les mécanismes moléculaires à l’origine de l’activation de plusieurs inflammasomes et leur rôle dans l’induction de la mort cellulaire inflammatoire. Cette découverte met en lumière le lien entre les capteurs immunitaires innés et fournit des informations précieuses sur les fonctions des inflammasomes dans l’immunité innée et la biologie des inflammasomes.
Les résultats offrent également un potentiel pour identifier de nouvelles cibles thérapeutiques pour les maladies médiées par NLRP3, AIM2, NLRC4 et Pyrin. L’étude a été publiée dans Immunologie cellulaire et moléculaire.
Les inflammasomes servent de sentinelles cruciales de la défense immunitaire innée, détectant les agents pathogènes et déclenchant la mort cellulaire des cellules infectées, jouant ainsi un rôle essentiel dans l’inflammation, le développement et le cancer. Ces capteurs d’inflammasome détectent des modèles moléculaires spécifiques associés à des agents pathogènes et à des dommages (PAMP et DAMP) et forment un complexe avec les adaptateurs ASC et caspase-1. Cependant, l’intégration de plusieurs capteurs d’inflammasomes pour une défense optimale de l’hôte est restée difficile à réaliser.
L’équipe de recherche, dirigée par le professeur SangJoon Lee du Département des sciences biologiques de l’UNIST, a étudié l’activation simultanée de plusieurs inflammasomes par divers ligands. Ils ont découvert que cette activation déclenchait des types distincts de mort cellulaire inflammatoire programmée, qui ne pouvaient pas être reproduites en traitant avec un seul ligand pur d’un inflammasome individuel.
L’équipe a identifié NLRP3, AIM2, NLRC4 et Pyrin comme membres d’un grand complexe multiprotéique, aux côtés d’ASC, de la caspase-1, de la caspase-8 et de RIPK3. Ce complexe s’est avéré piloter un processus appelé PANoptose, impliquant plusieurs types de mort cellulaire inflammatoire.
De plus, le complexe multiprotéique a été libéré dans l’espace extracellulaire, formant de multiples particules d’inflammasome extracellulaire. Ces particules, lorsqu’elles sont englouties par les macrophages voisins, provoquent une inflammation. Cette découverte met en évidence une connexion régulatrice et une interaction moléculaire jusqu’alors inconnues entre les capteurs de l’inflammasome, conduisant à l’assemblage d’un complexe multiprotéique comprenant plusieurs capteurs de l’inflammasome et des régulateurs de la mort cellulaire.
Les implications de ces résultats s’étendent au-delà de la recherche fondamentale. Comprendre les interactions critiques entre NLRP3, AIM2, NLRC4 et Pyrin ouvre de nouvelles voies pour comprendre les fonctions de ces molécules dans l’immunité innée et la biologie des inflammasomes. De plus, cela ouvre la voie à l’identification de cibles thérapeutiques potentielles pour les maladies médiées par ces inflammasomes.
Le professeur Lee a souligné l’importance de cette recherche en déclarant : « Notre étude fournit un nouveau paradigme pour comprendre les fonctions des capteurs de l’inflammasome et leur impact sur l’immunité innée. L’identification des interactions moléculaires clés et l’assemblage du complexe multiprotéique mettent en lumière les interactions complexes. mécanismes de défense immunitaire contre plusieurs agents pathogènes. Ces connaissances peuvent potentiellement guider le développement de nouvelles stratégies thérapeutiques pour les maladies associées à NLRP3, AIM2, NLRC4 et Pyrin.
L’équipe de recherche a mené des expériences sur des animaux et des souris pour valider leurs résultats. L’injection des particules inflammatoires libérées à des souris a entraîné une perte de poids, indiquant les effets nocifs de ces particules. Cependant, les souris dont les gènes associés à la mort cellulaire étaient inhibés ou supprimés n’ont pas subi de perte de poids, confirmant ainsi le rôle de la mort cellulaire médiée par l’inflammasome dans la progression de la maladie.
Plus d’information:
SuHyeon Oh et al, Integrated NLRP3, AIM2, NLRC4, activation de l’inflammasome de la pyrine et pilote d’assemblage PANoptosis, Immunologie cellulaire et moléculaire (2023). DOI : 10.1038/s41423-023-01107-9
Fourni par l’Institut national des sciences et technologies d’Ulsan
Citation: Une nouvelle étude révèle des interactions moléculaires à l’origine de l’activation de multiples inflammatoires et de la mort des cellules inflammatoires (30 novembre 2023) récupéré le 30 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.