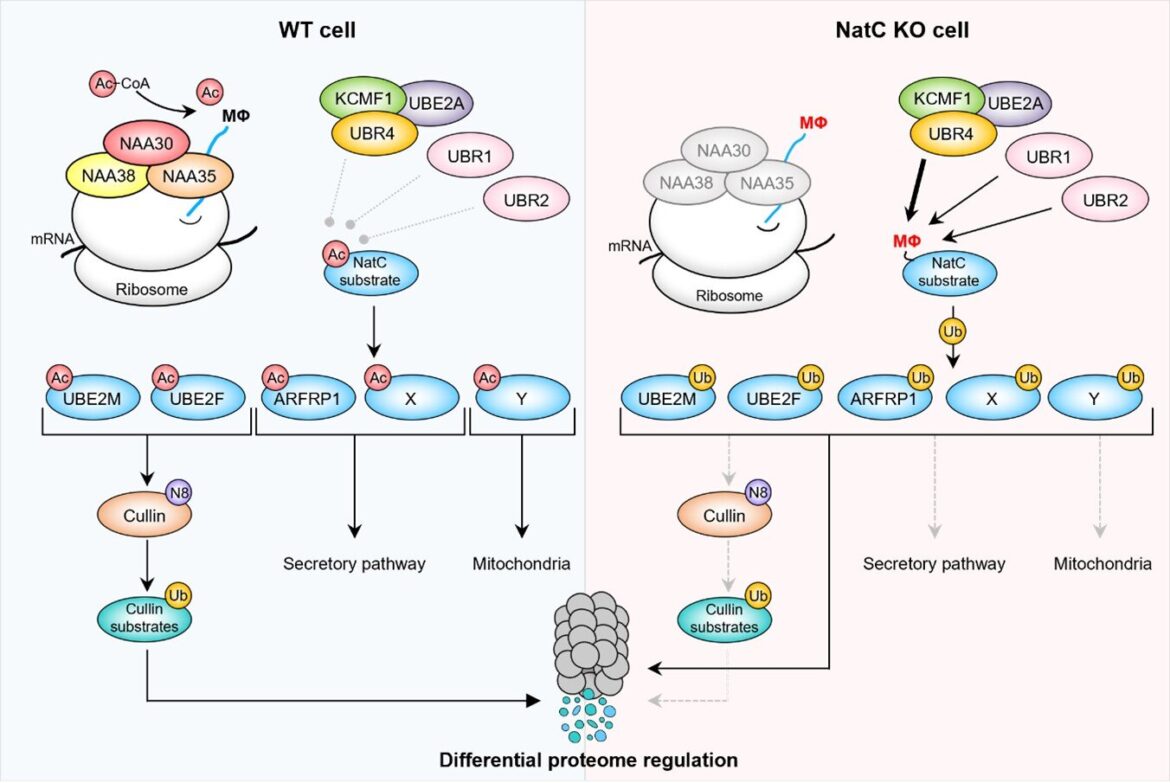
L’acétylation N-terminale par NatC protège les protéines de la dégradation. (À gauche) Le complexe NatC acétyle les protéines hébergeant un résidu hydrophobe en deuxième position (MΦ). Après la Nt-acétylation, Ac-UBE2M et Ac-UBE2F favorisent la neddylation de la culline (N8), entraînant une ubiquitylation (Ub) et une dégradation protéasomale des substrats de culline ciblés. Ac-ARFRP1 est ciblé sur le Golgi où il joue un rôle dans la voie de sécrétion. , tandis que les protéines hypothétiques Ac-X et Ac-Y affecteraient respectivement la voie de sécrétion et les mitochondries. (À droite) La perte de NatC expose les terminaisons N non acétylées de départ MΦ qui servent de N-dégrons qui peuvent être reconnus par un ensemble de N-reconnaissances conduisant à une dégradation protéasomale et, dans certains cas, lysosomale. Les substrats NatC non acétylés sont principalement ciblés par les ubiquitine ligases UBR4-KCMF1 et, dans une certaine mesure, UBR1 et UBR2. La dégradation ciblée des substrats NatC non acétylés entraîne une diminution de la neddylation de la culline, une augmentation de l’élongation et de la fragmentation des mitochondries et on pense qu’elle affecte le trafic intracellulaire. (Figure de Varland, Sylvia et al, 2023, Nature Communications). Crédit : Arnesen Lab, UiB
Des chercheurs de l’Université de Bergen (UiB) ont découvert que les protéines utilisent un marqueur chimique commun comme bouclier pour les protéger de la dégradation, ce qui affecte à son tour la motilité et le vieillissement.
Les protéines sont essentielles à tous les processus de nos cellules et comprendre leurs fonctions et leur régulation est d’une importance majeure.
“Depuis de nombreuses années, nous savons que presque toutes les protéines humaines sont modifiées par un groupe chimique spécifique, mais son impact fonctionnel reste indéfini”, explique le professeur Thomas Arnesen du département de biomédecine de l’université de Bergen.
Il explique : « L’une des modifications protéiques les plus courantes dans les cellules humaines est l’acétylation N-terminale, qui est l’ajout d’un petit groupe chimique (acétyle) à l’extrémité de départ (N-terminale) d’une protéine. un groupe d’enzymes appelés acétyltransférases N-terminales (NAT).” Bien qu’elle soit « partout » dans les cellules humaines, le rôle fonctionnel de cette modification reste mystérieux, explique Arnesen.
Il est chercheur dans une nouvelle étude qui révèle qu’une fonction essentielle de cette modification protéique est de protéger les protéines de la dégradation, ce qui est essentiel pour une longévité et une motilité normales.
Les résultats sont publiés dans la revue Communications naturelles.
La technologie CRISPR-Cas9 apporte un nouvel éclairage sur l’acétylation N-terminale
Pour répondre à cette question, la biologiste moléculaire et chercheuse Sylvia Varland a passé deux ans au Donnelly Centre for Cellular & Biomolecular Research, Université de Toronto, Canada.
Ici, elle a utilisé la technologie établie CRISPR-Cas9 et de puissantes plateformes de criblage disponibles dans l’un des meilleurs environnements scientifiques pour définir les rôles fonctionnels des enzymes NAT humaines. Sylvia s’est concentrée sur l’une des principales enzymes NAT humaines, NatC, et le criblage à l’échelle du génome des cellules NatC KO humaines a révélé de nombreux gènes humains susceptibles d’être impliqués dans la fonction de l’acétylation N-terminale.
“Sans l’environnement scientifique inspirant du Centre Donnelly combiné au soutien financier des actions Marie Skłodowska-Curie, cette étude n’aurait pas vu le jour”, déclare Varland.
De retour au laboratoire Arnesen de l’UiB, Sylvia a exploré les implications moléculaires de ses découvertes génétiques avec l’aide de son doctorat. l’étudiante Ine Kjosås et d’autres membres du laboratoire. Des expériences biochimiques, de biologie cellulaire et de protéomique ont démontré que l’acétylation N-terminale agit comme un bouclier pour protéger de nombreuses protéines de la dégradation des protéines. Les protéines dépourvues d’acétylation N-terminale ont été reconnues par la machinerie de dégradation cellulaire.
“L’acétylation N-terminale a le pouvoir de dicter la durée de vie d’une protéine et affecte nos cellules de nombreuses manières”, explique Varland. “C’est vrai pour les humains, mais aussi pour les mouches des fruits, qui constituent un modèle très utile pour étudier cette modification protéique”, poursuit-elle.
L’acétylation N-terminale peut affecter le vieillissement
En parallèle, un groupe de recherche du chercheur Rui Martinho de l’Université d’Aveiro au Portugal travaillait sur l’impact sur l’organisme de l’acétylation N-terminale médiée par NatC en utilisant un modèle de mouche des fruits (drosophile).
Le chercheur postdoctoral Rui Silva et ses camarades ont mené des études sur des mouches dépourvues d’acétylation N-terminale. Les deux équipes ont décidé de fusionner leurs efforts et coordonnent depuis deux ans leurs expérimentations. Les mouches dépourvues de NatC étaient viables, mais ces mouches présentaient une longévité et une motilité réduites avec l’âge. Ces effets pourraient être partiellement inversés en exprimant une protéine conservée entre la mouche et l’homme qui s’avère être une cible clé de la protection NatC.
Décoder le puzzle NatC
En conclusion, en utilisant un criblage génétique impartial et global combiné au phénotypage cellulaire, l’équipe a découvert une fonction générale de l’acétylation N-terminale dans la protection des protéines contre la dégradation dans les cellules humaines.
Les recherches moléculaires ont défini les composants cellulaires (ubiquitine ligases) responsables de la dégradation d’une classe majeure de protéines humaines en l’absence d’acétylation N-terminale. Le rôle de la protection de protéines spécifiques médiée par NatC est évident à la fois dans les cellules humaines et chez la mouche des fruits. L’impact de ces voies sur la longévité et la motilité chez les individus âgés souligne le rôle vital de l’acétylation de la protéine N-terminale.
“Ce travail dévoile certains secrets et montre comment l’acétylation N-terminale façonne le devenir des protéines individuelles”, conclut Thomas Arnesen.
Plus d’information:
Sylvia Varland et al, L’acétylation N-terminale protège les protéines de la dégradation et favorise la motilité et la longévité en fonction de l’âge, Communications naturelles (2023). DOI : 10.1038/s41467-023-42342-y
Fourni par l’Université de Bergen
Citation: Des chercheurs résolvent un mystère de longue date sur ce qui protège les protéines de la dégradation (27 octobre 2023) récupéré le 27 octobre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.