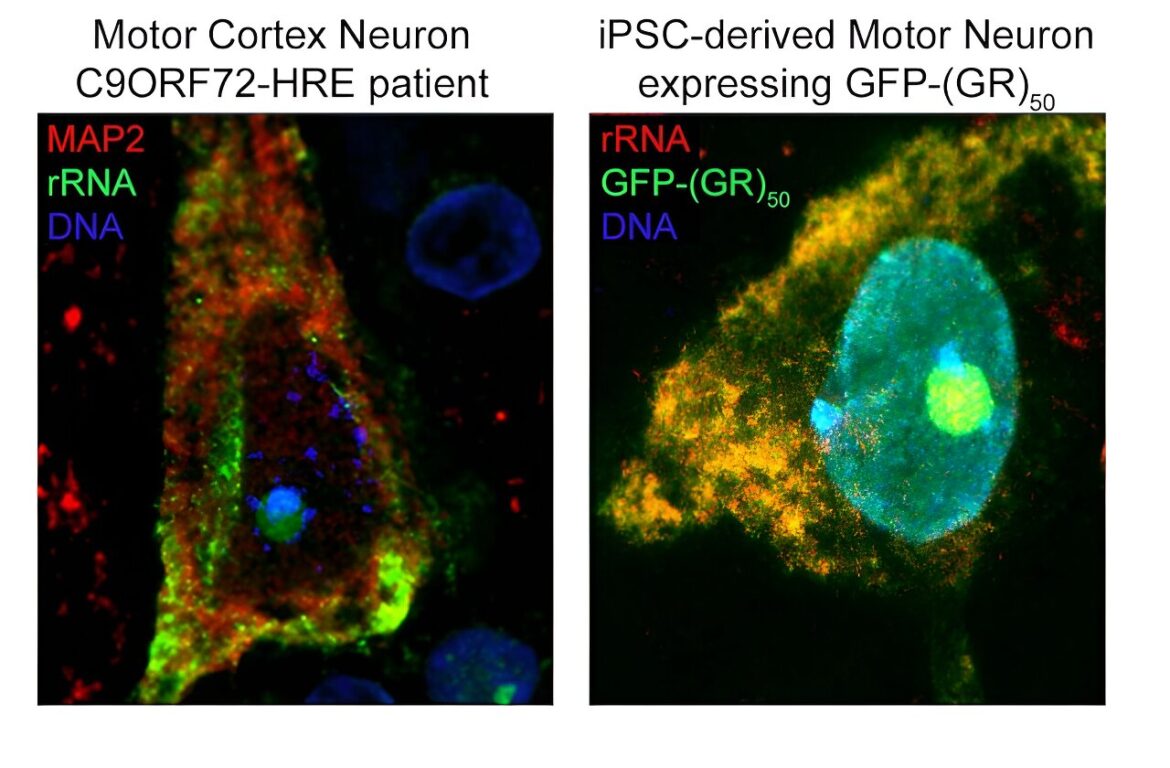
À gauche : neurone du cortex moteur d’un patient C9ORF72 coloré pour MAP2 et ARNr, montrant le modèle d’expression de l’ARN ribosomal dans un neurone humain, principalement au niveau du cytosol et du nucléole. À droite : motoneurone dérivé de l’iPSC transduit avec le lentivirus GFP-(GR)50 et coloré pour l’ARNr, montrant le chevauchement total du poly-GR et de l’ARNr dans les motoneurones humains. Crédit : Juan Ortega, Ph.D.
Deux études du laboratoire d’Evangelos Kiskinis, Ph.D., professeur agrégé à la Division des maladies neuromusculaires et des neurosciences du Département de neurologie Ken et Ruth Davee, ont découvert de nouveaux mécanismes cellulaires impliqués dans deux types de lésions latérales amyotrophiques génétiques. sclérose, ou SLA.
Les résultats, publiés dans Avancées scientifiques et Rapports de cellulesaméliorent la compréhension de la SLA, une maladie neurodégénérative progressive qui attaque les motoneurones du cerveau et de la moelle épinière, et soutiennent le développement futur de thérapies ciblées.
Mutations génétiques « appâtantes »
On estime que 32 000 personnes vivent actuellement avec la SLA aux États-Unis, selon la Fondation Les Turner ALS. Il existe deux types de SLA : sporadique (non génétique), qui représente plus de 90 % de tous les cas de SLA, et familiale (génétique).
Dans leur article publié dans Avancées scientifiquesl’équipe Kiskinis a étudié un type de SLA familiale provoquée par une séquence génétique répétée du gène C9ORF72, qui est la principale cause génétique de la SLA.
Selon Kiskinis, les individus en bonne santé peuvent avoir 20 répétitions de C9ORF72 dans leur génome, tandis que les patients atteints de SLA peuvent en avoir des milliers. Ces répétitions sont transcrites et traduites par des voies non canoniques qui produisent des ARN irréguliers et des dipeptides (molécules avec deux acides aminés liés par un peptide) dans les neurones.
L’équipe de Kiskinis a émis l’hypothèse que cet effet en cascade est à l’origine d’une toxicité de gain de fonction dans les motoneurones dans ce type de SLA. Cela les a incités à étudier les mécanismes qui rendent ces dipeptides répétés (R-DPR) de plus en plus toxiques.
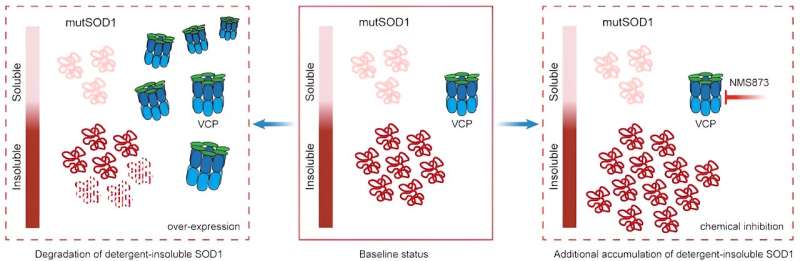
Lorsque VCP est surexprimé (à gauche) dans le contexte de la SOD1 mutante, les niveaux de protéine SOD1 insoluble dans les détergents diminuent. En revanche, lors de l’inhibition chimique du VCP avec NMS873 (à droite), il existe une accumulation significative de protéine SOD1 dans la fraction insoluble dans le détergent. Crédit : de Konstantinos Tsioras, Ph.D.
À l’aide de techniques informatiques et expérimentales, les chercheurs ont découvert que les R-DPR possèdent une forte affinité de liaison pour les molécules d’ARN. Ensuite, ils ont utilisé une technique appelée immunoprécipitation de réticulation, ou CLIP-seq, pour isoler des fragments d’ARN spécifiques et ont découvert que les R-DPR se lient exclusivement aux ARN ribosomiques. Plus précisément, le dipeptide poly-GR se lie à l’ARN ribosomal, ce qui altère l’homéostasie ribosomale, un processus essentiel à la différenciation cellulaire et à la composition globale d’une cellule.
En utilisant ces résultats, les enquêteurs ont ensuite conçu un « appât » à ARN, qui incite le poly-GR à se lier à quelque chose qui semble être de l’ARN ribosomal – ou dans ce cas, l’appât. Dans les modèles in vivo et dans les neurones iPSC dérivés de patients présentant des mutations C9ORF72, la molécule appât a inhibé la toxicité.
“Nous avons montré, en utilisant plusieurs approches différentes, que la molécule que nous avons conçue – “l’appât” – se lie très fortement et spécifiquement à cette protéine poly-GR et, en se liant à elle, l’empêche de se lier à l’ARN ribosomal et l’empêche d’entrer dans le noyau. , c’est là qu’il devient le plus toxique”, a déclaré Kiskinis.
“Cela sert de preuve de principe à l’idée qu’une molécule d’ARN qui possède ces capacités” d’appât “peut être thérapeutique et cela renforce également l’hypothèse selon laquelle une grande partie de la toxicité de la mutation C9ORF72 est associée à une altération de la biologie ribosomale.”
Les enquêteurs optimisent désormais la chimie de la molécule-appât et visent à la tester dans d’autres modèles de SLA, selon Kiskinis.
“Nous sommes enthousiasmés par le fait que les neurones dérivés d’iPSC provenant de patients présentant ces mutations survivent beaucoup plus longtemps lorsque nous leur donnons cette molécule appât, ce qui signifie qu’elle fait quelque chose de bien. Nous devons juste déterminer si cela pourrait être un thérapeutique viable et transformatrice », a déclaré Kiskinis.
Relier les gènes causals
Il existe 30 gènes connus associés aux formes familiales de SLA, mais la question de savoir si chaque facteur génétique contribue à un seul type général de SLA ou à plusieurs types reste une question imminente dans le domaine, selon Kiskinis.
Pour répondre à cette question, selon leur étude publiée dans Rapports de cellulesl’équipe de Kiskinis a utilisé des motoneurones spinaux à cellules souches pluripotentes induites (CSPi) dérivées de patients pour développer un modèle du deuxième type le plus courant de SLA familiale, qui est causée par des mutations du gène SOD1 et est apparente dans deux pour cent. de tous les cas de SLA.
“Nous savons, grâce aux travaux effectués dans le domaine au cours des 20 dernières années, que cette mutation provoque une toxicité par le biais d’effets de gain de fonction. Nous savons que les mutations conduisent à un mauvais repliement des protéines, et ce mauvais repliement déclenche une cascade qui conduit à dysfonctionnement. Mais comment cela se produit, nous ne comprenons pas très bien”, a déclaré Kiskinis.
Les enquêteurs ont utilisé la protéomique temporelle pour comparer les protéomes des neurones iPSC témoins et des neurones iPSC avec une mutation SOD1 et ont comparé le taux de dégradation des protéines (le recyclage et le remplacement des anciennes protéines) entre les deux ensembles de neurones.
Dans les neurones iPSC mutants SOD1, ils ont découvert qu’une autre protéine causale de la SLA, la protéine contenant de la valosine (VCP), se dégradait plus lentement que dans les neurones iPSC de contrôle isogénique. Cette lente dégradation des protéines a finalement amené le VCP à interagir moins avec certaines protéines et davantage avec d’autres protéines.
“C’est très excitant car on pense que les mutations du VCP qui peuvent causer la SLA agissent de la même manière”, a déclaré Kiskinis.
Les enquêteurs ont ensuite cherché à déterminer si cette fonction altérée du VCP jouait un rôle dans la toxicité médiée par SDO1. Dans les modèles de neurones de patients iPSC mutants SOD1 et de C. elegans (un type de vers ronds) de SOD1 mutante, les enquêteurs ont découvert que lorsque la VCP était surexprimée, la toxicité diminuait et lorsque la fonction de la VCP était inhibée, la toxicité augmentait.
“Cet article et les travaux que nous avons effectués dans notre laboratoire au cours des dernières années démontrent que même si les causes génétiques peuvent être différentes, il existe toujours une sorte de chevauchement mécanistique en ce qui concerne les causes du dysfonctionnement de ces cellules. “, a déclaré Kiskinis.
Ceci est important, a ajouté Kiskinis, car les résultats peuvent éclairer la conception de futurs essais cliniques et améliorer l’application de thérapies ciblées. À l’avenir, Kiskinis a déclaré que son équipe souhaite déterminer si le VCP est une cible thérapeutique efficace pour les patients présentant une mutation SOD1, ainsi que pour d’autres types de SLA.
Plus d’information:
Juan A. Ortega et al, l’analyse CLIP-Seq permet la conception d’oligonucléotides d’appât d’ARN ribosomal protecteur contre la physiopathologie poly-GR C9ORF72 ALS/FTD, Avancées scientifiques (2023). DOI : 10.1126/sciadv.adf7997
Konstantinos Tsioras et al, L’analyse de la dynamique de dégradation à l’échelle du protéome dans les neurones de patients dérivés d’ALS SOD1 iPSC révèle une homéostasie VCP perturbée, Rapports de cellules (2023). DOI : 10.1016/j.celrep.2023.113160
Fourni par l’Université Northwestern
Citation: Des études identifient de nouveaux fondements de la SLA génétique (14 novembre 2023) récupéré le 14 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.