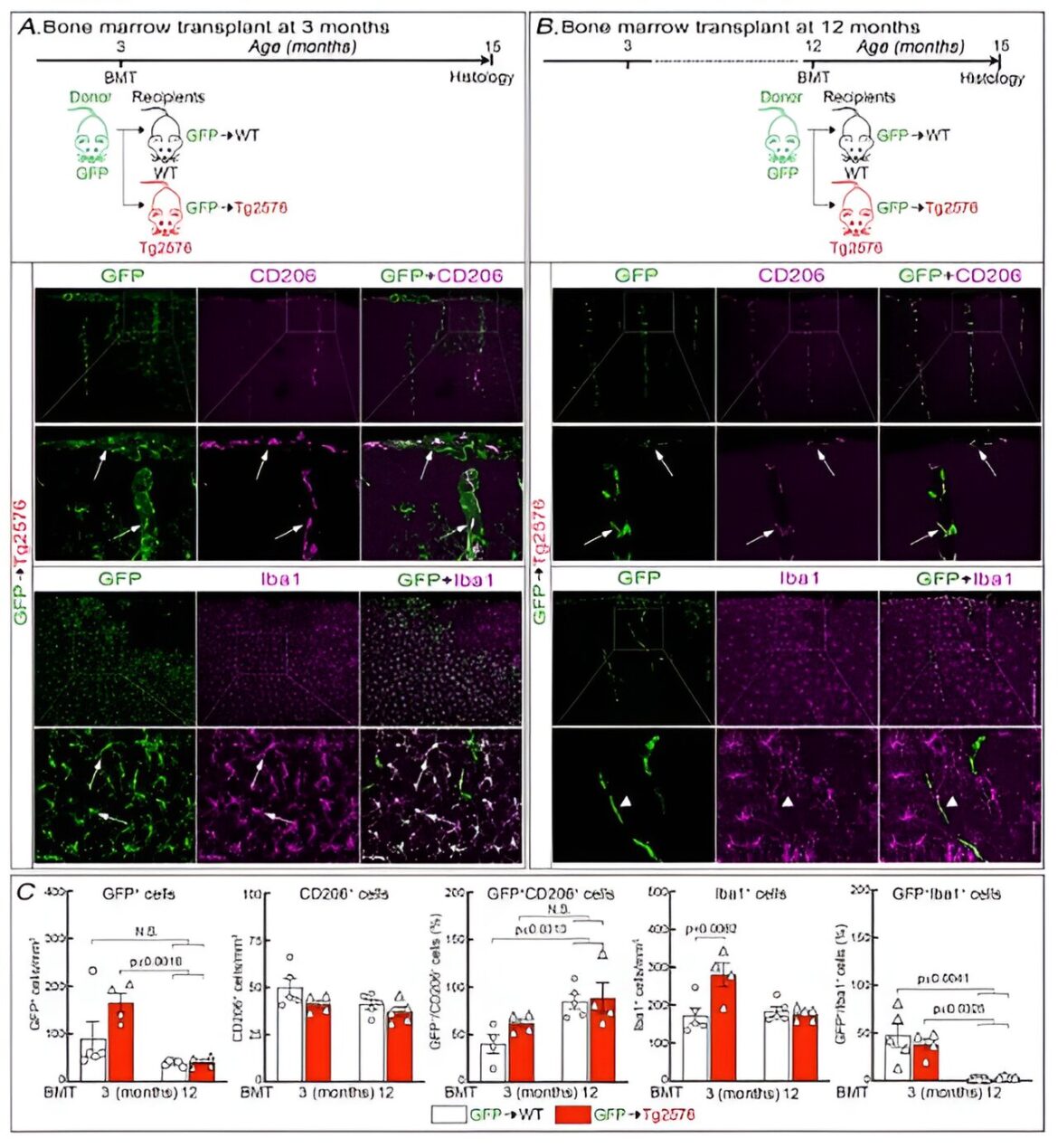
Crédit: Neurodégénérescence moléculaire (2023). DOI : 10.1186/s13024-023-00660-1
Des chercheurs de Weill Cornell Medicine ont démontré comment la bêta-amyloïde, un peptide associé à la maladie d’Alzheimer, peut interagir avec un récepteur protéique présent sur les cellules immunitaires du cerveau. Cela déclenche une réaction qui endommage les vaisseaux sanguins et provoque une neurodégénérescence.
Les résultats, publiés le 3 octobre dans Neurodégénérescence moléculairepourrait aider les chercheurs à comprendre comment la démence se développe dans des maladies telles que la maladie d’Alzheimer et l’angiopathie amyloïde cérébrale (AAC), qui coexistent souvent, et à découvrir des traitements indispensables.
La bêta-amyloïde est un sous-produit peptidique normal du fonctionnement cérébral, mais dans le CAA et la maladie d’Alzheimer, ces petites molécules s’accumulent et endommagent les parois des vaisseaux sanguins du cerveau. Les artères blessées peuvent provoquer des hémorragies cérébrales et contribuer à des troubles cognitifs, mais le mécanisme par lequel cela se produit est inconnu.
Des études antérieures ont montré que les macrophages associés aux frontières (cellules immunitaires qui entourent les vaisseaux sanguins du cerveau) possèdent à leur surface des récepteurs CD36 qui peuvent se lier à la bêta-amyloïde. Il s’avère que la bêta-amyloïde active le CD36, déclenchant la libération de radicaux libres d’oxygène, qui endommagent les parois artérielles et suppriment le flux sanguin nécessaire dans le cerveau.
“Le cerveau élimine normalement la bêta-amyloïde de manière très efficace, car nos vaisseaux sanguins aident à la pomper hors du cerveau pour rester en bonne santé. Mais nous avons découvert que lorsque la bêta-amyloïde s’accumule, elle “chatouille” les macrophages associés aux frontières, qui libèrent de grandes quantités de radicaux libres toxiques, ” a déclaré l’auteur principal de l’étude, le Dr Costantino Iadecola, directeur et président du Feil Family Brain and Mind Research Institute et professeur de neurologie Anne Parrish Titzell à Weill Cornell Medicine.
Les chercheurs ont découvert que les radicaux libres paralysaient les vaisseaux sanguins du cerveau.
“L’amyloïde s’accumule ensuite dans les muscles lisses des parois des vaisseaux, ce qui bloque la capacité du vaisseau à pomper le sang vers le cerveau”, a déclaré Iadecola. “La CAA et les troubles cognitifs en sont le résultat malheureux.”
L’équipe d’étude comprenait également l’auteur co-correspondant Laibaik Park, professeur agrégé de neurosciences au Feil Family Brain and Mind Research Institute, et le premier auteur, le Dr Ken Uekawa, qui était chercheur invité à Weill Cornell Medicine au cours de cette recherche.
En commençant par un modèle préclinique de la maladie d’Alzheimer avec CAA et troubles cognitifs, les chercheurs ont éradiqué le CD36 dans les macrophages associés aux frontières.
“Nous avons montré que l’élimination des récepteurs CD36 dans les macrophages associés aux frontières améliorait la fonction vasculaire et réduisait l’accumulation de bêta-amyloïde autour des vaisseaux sanguins. Plus important encore, la fonction cognitive des souris s’améliorait”, a déclaré Park.
Les chercheurs ont également découvert que sans CD36, les macrophages produisaient moins de radicaux oxygène réactifs.
Ces résultats démontrent un nouveau rôle pour les macrophages associés aux frontières dans le déclin cognitif : la bêta-amyloïde induit la production de radicaux libres d’oxygène, qui endommagent les artères, provoquent des dépôts de bêta-amyloïde dans les parois artérielles et un déclin cognitif. Iadecola et ses collègues ont conclu que la suppression du CD36 dans les macrophages associés aux frontières supprimait le stress oxydatif, améliorait la fonction neurovasculaire et favorisait la clairance bêta-amyloïde du cerveau, de sorte qu’elle ne lésait pas les artères.
Par conséquent, cibler le CD36 dans les macrophages associés aux frontières peut bénéficier à la CAA et à d’autres conditions associées à l’accumulation d’amyloïde sur les vaisseaux sanguins. Par exemple, les chercheurs pensent que cette découverte pourrait aider à trouver un traitement pour les anomalies d’imagerie liées à l’amyloïde (ARIA). Il s’agit d’une réaction potentiellement grave aux médicaments à base d’anticorps monoclonaux, comme l’aducanumab, utilisés pour traiter les patients présentant des troubles cognitifs légers et la maladie d’Alzheimer.
Chez une grande proportion de patients recevant cette immunothérapie bêta-amyloïde à la dose la plus élevée, les IRM montrent qu’un œdème cérébral ou des hémorragies sont survenus depuis le début du traitement. Actuellement, ces patients doivent arrêter le médicament, mais contrecarrer l’ARIA pourrait améliorer le succès de l’immunothérapie bêta-amyloïde.
Iadecola a conclu : « Après avoir terminé nos travaux translationnels dans les années à venir, nous espérons déterminer si le blocage du CD36 dans les macrophages cérébraux ou leur manipulation d’une autre manière pourrait éliminer les accumulations anormales de bêta-amyloïde chez les patients traités par immunothérapie bêta-amyloïde.
Plus d’information:
Ken Uekawa et al, Les macrophages associés aux frontières favorisent l’angiopathie amyloïde cérébrale et les troubles cognitifs dus au stress oxydatif vasculaire, Neurodégénérescence moléculaire (2023). DOI : 10.1186/s13024-023-00660-1
Fourni par l’Université Cornell
Citation: L’équipe trouve un nouveau coupable dans l’accumulation de bêta-amyloïde et la neurodégénérescence (8 novembre 2023) récupéré le 8 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.