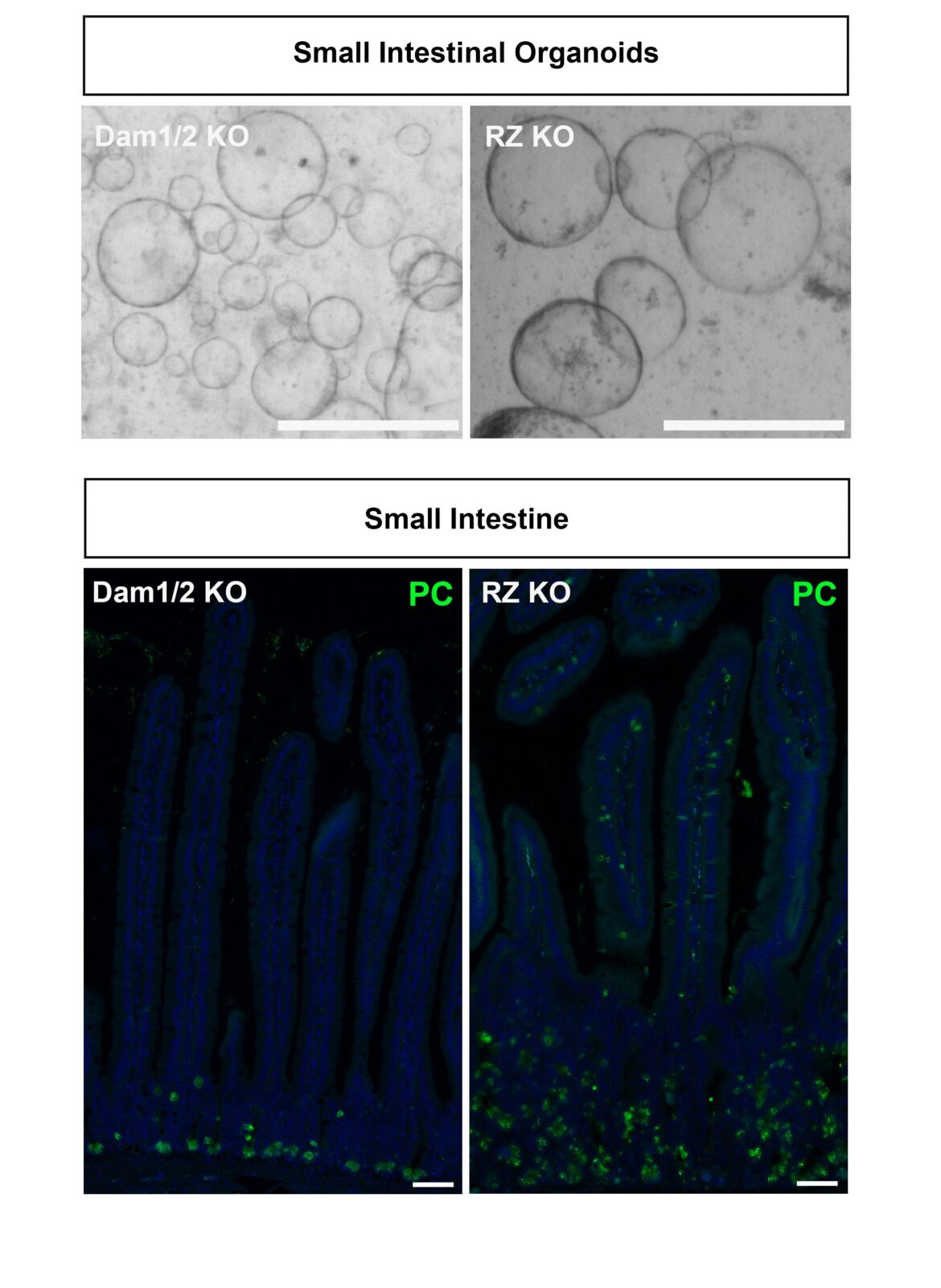
En haut : les cellules souches intestinales dépourvues de Daam1 (à gauche) ou de Rnf43 (à droite) forment des organoïdes ressemblant à des tumeurs. Crédit : Gabriele Colozza/IMBA
Les cellules souches peuvent se différencier pour remplacer les cellules mortes et endommagées. Mais comment les cellules souches décident-elles quel type de cellule devenir dans une situation donnée ? À l’aide d’organoïdes intestinaux, le groupe de Bon-Kyoung Koo de l’IMBA et de l’Institut des sciences fondamentales a identifié un nouveau gène, Daam1, qui joue un rôle essentiel en déclenchant le développement des cellules sécrétoires dans l’intestin.
Ce constat, publié le 24 novembre dans Avancées scientifiquesouvre de nouvelles perspectives dans la recherche sur le cancer.
Notre corps est, à certains égards, comme une voiture : pour continuer à fonctionner, il doit être vérifié et réparé régulièrement. Dans le cas de notre corps, toutes les cellules endommagées ou mortes doivent être remplacées pour que les organes continuent de fonctionner. Ce remplacement se produit grâce aux cellules souches adultes résidant dans les tissus.
Contrairement aux cellules souches embryonnaires, qui peuvent former n’importe quel type de cellules dans le corps, les cellules souches adultes ne formeront que les types de cellules trouvés dans les tissus auxquels elles appartiennent. Mais comment les cellules souches spécifiques à un tissu savent-elles à quel type de cellule donner naissance ?
Gabriele Colozza, chercheur postdoctoral dans le laboratoire de Bon-Kyoung Koo à l’IMBA – aujourd’hui directeur du Centre d’ingénierie du génome de l’Institut des sciences fondamentales en Corée du Sud – a décidé d’étudier cette question en utilisant des cellules souches intestinales.
Les intestins, un chantier de construction constant
“Dans nos intestins, les cellules sont exposées à des conditions extrêmes”, explique Colozza. L’usure mécanique, mais aussi les enzymes digestives et les variations de pH affectent les cellules intestinales. À leur tour, les cellules souches de la muqueuse intestinale se différencient pour former de nouvelles cellules intestinales.
“Les cellules endommagées doivent être remplacées, mais il s’agit d’un équilibre délicat entre le renouvellement des cellules souches et la différenciation en d’autres types de cellules : une prolifération incontrôlée des cellules souches peut conduire à la formation de tumeurs ; en revanche, si trop de cellules souches se différencient, le tissu être épuisé en cellules souches et finalement incapable de s’auto-renouveler.
Cet équilibre est délicatement réglé par des voies de signalisation et des boucles de rétroaction, qui permettent aux cellules de communiquer entre elles. Une voie importante s’appelle Wnt. La voie Wnt est connue pour son rôle dans le développement embryonnaire et, si elle n’est pas contrôlée, une voie Wnt trop active peut conduire à une division cellulaire excessive et à la formation de tumeurs.
Partenaire moléculaire identifié
Un antagoniste bien connu de la signalisation Wnt, qui contrôle Wnt, est Rnf43, qui a été initialement identifié par Bon-Kyoung Koo. Avant cette étude, Rnf43 était connu pour cibler le récepteur Wnt Frizzled et le marquer en vue de sa dégradation.
“Nous voulions savoir comment fonctionne Rnf43, et aussi ce qui, à son tour, contrôle Rnf43 et l’aide à réguler la signalisation Wnt.” Grâce à des recherches antérieures, les scientifiques savaient que Rnf43 à lui seul n’était pas suffisant pour décomposer le récepteur Wnt Frizzled, situé dans la membrane plasmique.
“Dans notre projet, nous avons utilisé des tests biochimiques pour identifier les protéines qui interagissent avec Rnf43.” Un partenaire clé de Rnf43 s’est avéré être la protéine Daam1.
Pour comprendre comment Daam1 régule Rnf43 et affecte les tissus dans lesquels il agit, Colozza s’est tourné vers les organoïdes intestinaux.
“Nous avons constaté que Daam1 est nécessaire pour que Rnf43 soit actif, donc pour que Rnf43 régule la signalisation Wnt. Des travaux ultérieurs sur les cellules ont montré que Rnf43 a besoin de Daam1 pour déplacer le récepteur Wnt Frizzled dans des vésicules appelées endosomes. Depuis les endosomes, Frizzled est transporté vers les lysosomes où il est dégradé, atténuant ainsi la signalisation Wnt”, ajoute Colozza.
Les organoïdes intestinaux sont des cultures cellulaires tridimensionnelles cultivées à partir de cellules souches intestinales adultes, permettant aux chercheurs d’imiter la muqueuse intestinale.
Pour Colozza, les organoïdes étaient l’occasion de comprendre comment Rnf43 et Daam1 affectent l’équilibre délicat du renouvellement et de la différenciation des cellules souches dans l’intestin. “Nous avons constaté que lorsque nous éliminons Rnf43 ou Daam1, les organoïdes se transforment en structures ressemblant à des tumeurs. Ces organoïdes ressemblant à des tumeurs continuent de croître, même si nous retirons les facteurs de croissance dont ils dépendent habituellement, tels que la R-spondine.”
Activation de la formation de cellules de Paneth
Lorsque Colozza a suivi ce résultat sur des tissus de souris, les chercheurs ont été surpris.
“Lorsque Rnf43 manquait, les intestins produisaient des tumeurs, comme prévu. Mais lorsque Daam1 manquait, aucune tumeur ne se développait. Nous étions intrigués par cette différence frappante : comment la perte de facteurs dans la même voie, qui se comportent de manière similaire dans les organoïdes, peut-elle conduire à des résultats si différents ? »
En examinant de près les intestins, Colozza a constaté que les intestins dépourvus de Rnf43 étaient remplis d’un type spécifique de cellules sécrétoires, les cellules de Paneth. En revanche, les intestins dépourvus de Daam1 ne contenaient aucune cellule de Paneth supplémentaire. Les cellules de Paneth sécrètent des facteurs de croissance, tels que Wnt, qui stimulent la division cellulaire.
“Daam1 est nécessaire à la formation efficace des cellules de Paneth. Lorsque Daam1 est actif, les cellules souches se différencient pour former des cellules de Paneth. Lorsque Daam1 n’est pas actif, les cellules souches se différencient en un autre type de cellule.”
Les tumeurs modifient leur niche pour se développer
Ce lien entre les résultats moléculaires et les cellules de Paneth explique la différence déroutante entre les intestins et les organoïdes.
“Dans la culture organoïde, nous, scientifiques, fournissons des facteurs de croissance, de sorte que l’inactivation de Rnf43 et de Daam1 conduit à des organoïdes ressemblant à des tumeurs. Mais dans l’intestin, aucun petit scientifique ne fournit des facteurs de croissance. Au lieu de cela, les cellules de Paneth fournissent des facteurs de croissance, comme Wnt. , et créent les bonnes conditions pour que les cellules souches survivent et se divisent.
“Lorsque les cellules de Paneth manquent, par exemple lorsque Daam1 n’est pas actif pour conduire les cellules à devenir des cellules de Paneth, les cellules souches ne se divisent pas beaucoup. Mais lorsqu’il y a trop de cellules de Paneth, comme dans les intestins dépourvus de Rnf43, les facteurs de croissance excessifs peuvent contribuer à la formation de tumeurs.
L’étude de Colozza et de ses collègues est la première preuve génétique que Daam1, membre de la voie non canonique Wnt, est important pour la spécification des cellules de Paneth et directement impliqué dans le développement de cette cellule sécrétoire cruciale. Les résultats mettent également en lumière l’importance de la niche des cellules souches. “Nous montrons que les cellules tumorales modifient leur microenvironnement et influencent leur environnement de soutien afin qu’elles puissent mieux se développer.”
Plus d’information:
Gabriele Colozza et al, La différenciation des cellules intestinales de Paneth repose sur une régulation asymétrique de la signalisation Wnt par Daam1/2, Avancées scientifiques (2023). DOI : 10.1126/sciadv.adh9673. www.science.org/doi/10.1126/sciadv.adh9673
Fourni par l’Institut de biotechnologie moléculaire de l’Académie autrichienne des sciences
Citation: Décodage du destin cellulaire : mécanisme clé du changement de cellules souches identifié (24 novembre 2023) récupéré le 24 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.