Crédit: Cellule (2023). DOI : 10.1016/j.cell.2023.11.019
Les chercheurs ont découvert de nouveaux gènes perturbés et un modèle moléculaire inattendu – appelé BREACHes – liés au syndrome du X fragile (FXS), une maladie génétique estimée par les Centers for Disease Control and Prevention qui affecte environ 1 homme sur 7 000 et environ 1 femme sur 11 000.
L'étude, réalisée par des chercheurs de l'École de médecine Perelman de l'Université de Pennsylvanie, qui a utilisé des cellules et des tissus cérébraux donnés par des patients, a également montré que la simple modification de la longueur du motif répétitif anormal pouvait restaurer les gènes réduits au silence sur plusieurs chromosomes. L'étude a été publiée dans la revue Cellule.
“Nos résultats ont des implications pour les futures stratégies de traitement du syndrome du X fragile et mettent en évidence des mécanismes potentiels contribuant à l'instabilité du génome qui peuvent également être à l'origine d'autres maladies”, a déclaré Linda Zhou, MD, Ph.D., co-premier auteur de l'étude, résidente clinique en dermatologie. à Penn Medicine.
Une équipe dirigée par l'auteur principal Jennifer Phillips-Cremins, Ph.D., professeure agrégée en bio-ingénierie et génétique et membre de l'Institut d'épigénétique de Penn Medicine, a étudié le FXS, la forme la plus courante de déficience intellectuelle héréditaire, afin de ajouter une compréhension de la cause sous-jacente du trouble. Les modèles manuels l'attribuent à la désactivation d'un seul gène, FMR1, et à la perte de la protéine codée par FMR1, la Fragile X Messenger Ribonucleoprotein (FMRP).
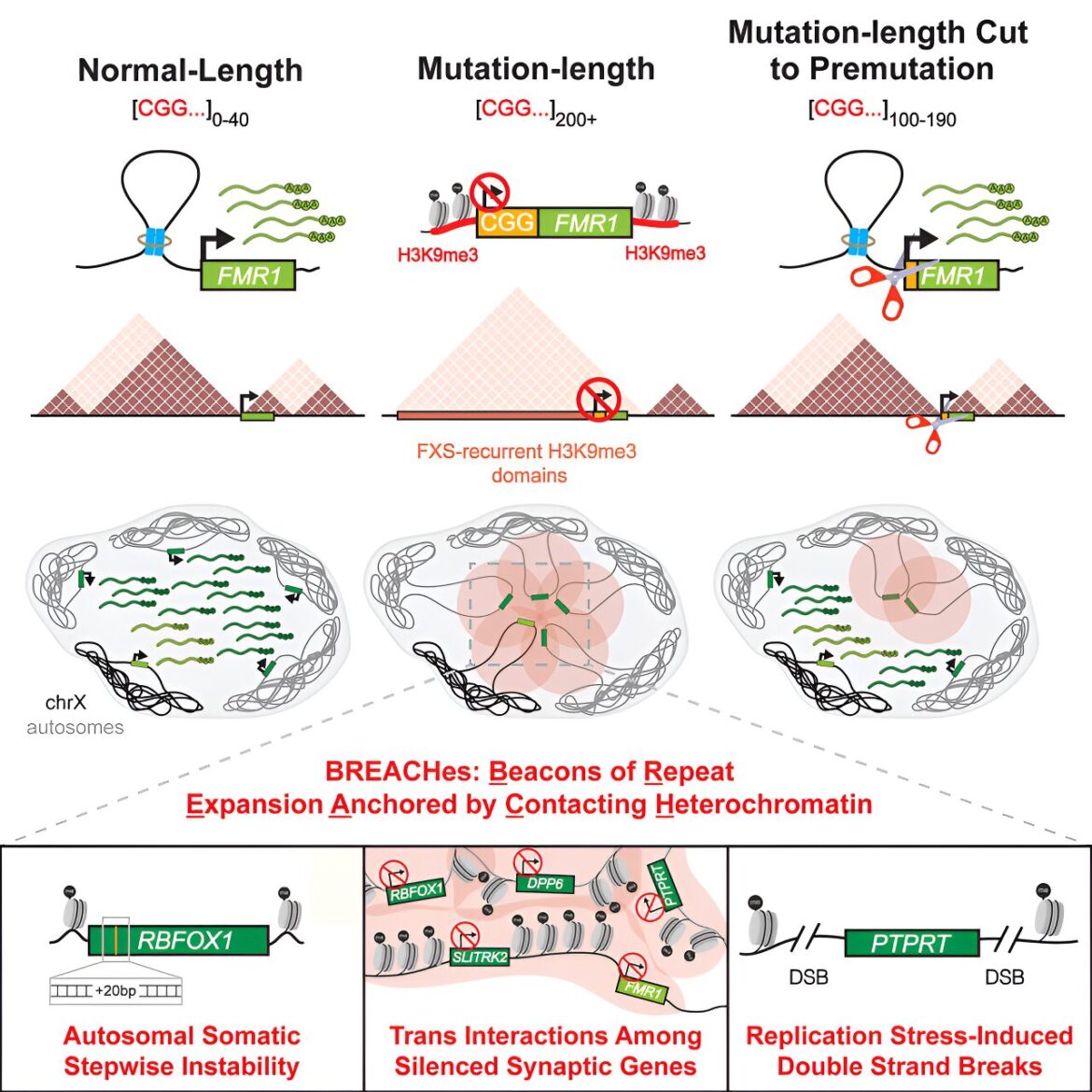
Il est largement admis que la perte de FMRP provoque une dérégulation sévère des synapses, qui relient les neurones du cerveau, ainsi qu'une perturbation de la façon dont les gènes sont exprimés dans les noyaux des neurones. Le principal modèle de FXS a été construit sur des études utilisant une souris transgénique dans laquelle le gène FMR1 a été inactivé. Cependant, le modèle murin manquait du moteur génétique critique du FXS : une mutation appelée « expansion répétée », qui se produit lorsqu'une longue répétition d'une séquence de deux lettres d'ADN ou plus devient instable et anormalement longue (une répétition de longueur de mutation) .
Pour FXS, il s’agit de la séquence de trois lettres – CGG – apparaissant à une extrémité du gène FMR1. Alors qu'une version normale de FMR1 comporte 40 triplets CGG ou moins dans le tractus répété, un patient FXS aura 200 triplets ou plus. L'anomalie déclenche une réponse défensive de la cellule, qui fait essentiellement taire FMR1 et FMRP. Parce que la séquence répétitive est difficile à concevoir, les petits modèles animaux de FXS ne disposent pas du tractus répété et n'ont donc peut-être pas démontré d'aspects importants du rôle de l'ADN répétitif dans les mécanismes sous-jacents au FXS.
Dans leur nouvelle étude, l’équipe de recherche a utilisé une gamme de techniques avancées de séquençage et d’imagerie, ainsi que des lignées cellulaires humaines et des tissus cérébraux avec l’expansion des répétitions CGG, pour découvrir de nouveaux modèles surprenants de perturbation du génome dans le FXS. Les chercheurs ont découvert que de larges étendues de chromosomes multiples dans les échantillons de patients FXS, qui incluent la répétition CGG, sont marquées par l'hétérochromatine inactivante. Ces « domaines » d’hétérochromatine sont appelés BREACHes – Balises d’ancrage à expansion répétée en contact avec l’hétérochromatine.
Les BREACHes se regroupent en groupes en contact physique dans le noyau et font taire les gènes impliqués dans les connexions synaptiques des neurones, ainsi que les gènes liés à l'intégrité du tissu conjonctif tel que la peau et les articulations. Des perturbations des synapses et du tissu conjonctif sont observées chez les patients FXS en clinique. Par conséquent, la capacité d'identifier les BREACHes a la possibilité d'être un outil puissant pour trouver des gènes perturbés potentiellement importants au-delà de FMR1.
Les chercheurs ont également testé si la répétition pouvait être directement liée aux BREACHes en utilisant la technologie d’édition génétique CRISPR-Cas pour réduire l’expansion du CGG à une longueur non provoquant le FXS.
“Lorsque nous avons réduit CGG à une longueur plus courte appelée prémutation (100 à 190 triplets), nous avons observé que bon nombre des grandes bandes d'hétérochromatine inhibant l'hétérochromatine étaient inversées et que plusieurs chromosomes étaient spatialement déconnectés de FMR1”, a déclaré le co-auteur principal Ken Chandradoss, Ph.D. et Ravi Boya, Ph.D., tous deux chercheurs postdoctoraux dans le laboratoire de Phillips-Cremins.
Les expériences de l'équipe ont démontré que les gènes initialement réduits au silence par BREACHes étaient réexprimés dans les cellules FXS avec la répétition CGG raccourcie par CRISPR.
“L'impact général de notre découverte selon laquelle l'expansion du CGG de longueur de mutation est nécessaire au maintien des BREACHes est que l'ingénierie répétée seule peut potentiellement être utilisée comme approche thérapeutique pour inverser l'inactivation à l'échelle du génome de plusieurs gènes critiques contribuant potentiellement aux présentations cliniques du FXS. “, a déclaré le co-auteur principal Thomas Malachowski, titulaire d'un doctorat. étudiant dans le laboratoire de Cremins.
Les futurs traitements FXS pourraient explorer le remplacement des fonctions de certains des gènes réduits au silence identifiés dans l’étude, et pas seulement de FMR1. Les chercheurs ont toutefois noté qu'une stratégie plus ambitieuse consisterait à réduire l'expansion excessivement longue des répétitions CGG à un moment défini du développement afin de prévenir ou au moins d'inverser les effets de la désactivation de l'hétérochromatine.
Pour explorer cette possibilité, il faudrait soigneusement équilibrer les effets positifs de la réactivation de gènes importants avec le rôle protecteur de l'hétérochromatine dans la protection contre l'instabilité du génome répétitif.
Parmi les autres troubles potentiellement touchés par ces résultats figurent la maladie de Huntington et la sclérose latérale amyotrophique (maladie de Lou Gehrig), qui font partie de la même classe plus large de troubles d'expansion répétée que le FXS, dont on pense qu'ils sont dus à la mutation d'un seul tractus répétitif dans l’ADN.
Phillips-Cremins a également expliqué que l'équipe a observé des INFRACTIONS dans d'autres modèles cellulaires humains d'instabilité du génome, notamment avec des lignées cellulaires contenant des mutations trouvées dans le cancer ou dans des cassures d'ADN induites en laboratoire.
“Nos résultats suggèrent que les BRÈCHES pourraient à l'avenir avoir un impact plus large sur l'inactivation des gènes dans d'autres maladies présentant une instabilité du génome, notamment certains cancers et d'autres troubles d'expansion répétée”, a-t-elle déclaré.
Plus d'information:
Thomas Malachowski et al, Hétérochromatinisation spatialement coordonnée de gènes synaptiques longs dans le syndrome du X fragile, Cellule (2023). DOI : 10.1016/j.cell.2023.11.019
Cellule
Fourni par la Perelman School of Medicine de l'Université de Pennsylvanie
Citation: Des chercheurs découvrent un schéma moléculaire inattendu dans le syndrome du X fragile (27 décembre 2023) récupéré le 27 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.