Cette image est une reconstruction 3D montrant les sites (en rouge) où se trouve le Coat Protein Complex II (COPII) qui facilite l'empaquetage de diverses protéines dans une cellule de mammifère. Les zones vertes sont le réticulum endoplasmique, où s'effectuent le tri et le trafic des protéines. Crédit : Anjon Audhya
À l’instar des facteurs qui parviennent à livrer leurs colis malgré la neige, la pluie, la chaleur et l’obscurité, un groupe essentiel de protéines de mammifères aide les cellules à fonctionner correctement, même dans des conditions loin d’être idéales.
Grâce à une technologie de pointe d’imagerie cellulaire et d’édition du génome, les scientifiques de l’Université du Wisconsin-Madison ont commencé à comprendre comment cet ensemble de protéines remplit son service essentiel. Cette découverte pourrait éventuellement aider les chercheurs à mieux comprendre et développer de nouveaux traitements pour des maladies comme le cancer, le diabète et celles qui provoquent un dysfonctionnement immunitaire.
Dirigée par Anjon Audhya, professeur au Département de chimie biomoléculaire, l’équipe de recherche a cherché à mieux comprendre le fonctionnement du Coat Protein Complex II, ou COPII. COPII est un groupe extrêmement important de protéines responsables du transport d’environ un tiers de toutes les protéines qui fonctionnent dans les cellules de mammifères.
COPII a fait l'objet du prix Nobel de physiologie ou médecine 2013, décerné à un trio de scientifiques pour leurs travaux définissant la manière dont les protéines sont triées et transportées autour des cellules. Cette nouvelle recherche s’appuie sur certaines de ces découvertes.
Il existe des millions de protéines dans les cellules des mammifères et elles remplissent une grande variété de fonctions. Les cellules doivent garantir que les protéines sont déplacées efficacement vers leurs emplacements appropriés, afin qu'elles puissent remplir leurs rôles cellulaires, une tâche complexe nécessitant de la précision. Des recherches antérieures ont identifié COPII comme une partie essentielle de ce processus, mais personne n'avait enregistré exactement comment cet ensemble de protéines emballer et transporter d'autres protéines autour des cellules.
Pour ce faire, Audhya et ses collègues ont utilisé l'outil d'édition du génome CRISPR/Cas9 pour ajouter une étiquette, qui pourrait être chimiquement liée à un colorant fluorescent brillant, à des protéines individuelles impliquées dans le contrôle du flux de circulation au sein des cellules, y compris certaines qui composent le complexe COPII. Grâce à cette étiquette, les scientifiques pourraient suivre les protéines à mesure qu'elles se déplacent dans les cellules vivantes.
À l'aide d'une technique appelée imagerie par feuille de lumière sur réseau, l'équipe a suivi comment COPII aide à obtenir des protéines cellulaires, y compris des molécules destinées à d'autres endroits, là où elles sont censées aller, ce qui n'avait jamais été fait auparavant.
L'équipe a décrit ses avancées dans un article récemment publié dans la revue Communications naturelles. Audhya l'a décrit en termes de système postal. Les chercheurs savaient que COPII fonctionnait comme des postiers qui récupéraient et livraient les colis, mais ils n'avaient jamais suivi ces travailleurs pendant qu'ils triaient les colis via les systèmes de distribution et de livraison de la cellule.
“Nous pouvons maintenant voir cette enveloppe dans la boîte aux lettres, voir comment le facteur vient à la boîte aux lettres pour récupérer la lettre, puis repartir”, explique Audhya, doyenne associée principale pour la recherche fondamentale, la biotechnologie et les études supérieures à l'Université de Toronto. l'École de médecine et de santé publique.
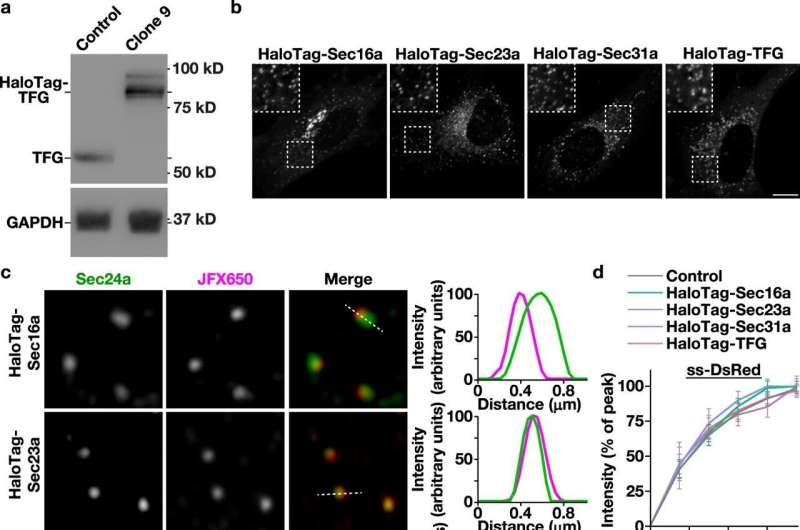
Ingénierie de lignées cellulaires humaines pour étudier la dynamique native du COPII. un Immunoblots représentatifs (n = 3) d'extraits générés à partir de cellules témoins et clonales éditées par CRISPR/Cas9 à l'aide d'anticorps dirigés contre TFG (en haut) et GAPDH (en bas). b Des images confocales représentatives de lignées cellulaires exprimant nativement les protéines de fusion HaloTag après marquage avec le ligand JFX650-HaloTag sont présentées. Les encarts montrent des régions zoomées 3x (encadrées). Barre, 10 µm. c Images représentatives en super résolution de cellules fixes exprimant les protéines de fusion HaloTag marquées avec le ligand JFX650-HaloTag (magenta) et co-colorées à l’aide d’anticorps dirigés contre Sec24a (vert). Des balayages linéaires codés par couleur mettant en évidence leurs localisations relatives sont affichés (à droite). Barre, 500 nm. d Imagerie confocale de lignées cellulaires modifiées (HaloTag-Sec16a, vert ; HaloTag-Sec23a, bleu clair ; HaloTag-Sec31a, violet ; HaloTag-TFG, saumon) co-exprimant soit ss-DsRed (en haut), soit ManII-SBP-GFP (en bas) ) a été utilisé pour surveiller leur libération synchrone depuis les urgences. Sur la base de l'intensité de la fluorescence, le pourcentage de chaque cargaison présente dans la région périnucléaire par rapport à son accumulation maximale a été quantifié au fil du temps. Les barres d'erreur représentent la moyenne +/- SEM (n = 20 cellules chacune ; 3 répétitions biologiques chacune). ***p= 0,0003, **p= 0,0082, et *p= 0,0260, calculé à l'aide d'une ANOVA bidirectionnelle et du test de comparaison multiple de Dunnett. e La microscopie confocale a été utilisée pour surveiller la récupération de fluorescence de HaloTag-Sec16a marqué avec le ligand JFX650-HaloTag après photoblanchiment partiel (n= 20 ; 3 répétitions biologiques). L'erreur, affichée par les bandes de couleur verte autour de la ligne de bande de roulement lissée, représente la moyenne +/- SEM. Sur la base de la courbe de récupération, la fraction mobile (MF) et mi-temps de récupération (t1/2) étaient déterminés. Les données sources sont fournies sous forme de fichier de données sources. Crédit: Communications naturelles(2023). DOI : 10.1038/s41467-023-44002-7
Les chercheurs ont découvert qu’en moyenne, ce processus de livraison prend entre 45 et 60 secondes dans des conditions normales. Cependant, lorsque les cellules reçoivent une nutrition médiocre, comme c’est parfois le cas, en raison de certaines maladies et conditions environnementales, ce processus ralentit considérablement jusqu’à ce que les cellules s’adaptent au fil du temps.
Grâce à une série d'expériences, Audhya et ses collègues ont identifié une protéine unique nommée Sec23, capable d'aider à restaurer le système de trafic de COPII après une perturbation. Lorsque les scientifiques ont augmenté la quantité de Sec23 produite à l'intérieur des cellules, ils ont constaté un changement dans la vitesse à laquelle les cellules transportaient les protéines, “quelque chose que nous n'avions jamais prévu lorsque nous avons commencé ce travail”, explique Audhya. “Sec23 semble être l'acteur central dans la régulation du fonctionnement du complexe COPII.”
Identifier ce qui déclenche Sec23 pour promouvoir la fonction COPII a des implications potentielles pour un certain nombre de maladies. Par exemple, les cellules cancéreuses se développent souvent de façon prodigieuse dans des environnements pauvres en nutriments, en partie en produisant davantage de certaines protéines qui favorisent la croissance. Comprendre les mécanismes moléculaires qui sont à la base de cette propriété pourrait identifier de nouvelles cibles thérapeutiques.
Au-delà de cela, une image plus précise du processus par lequel les cellules préparent et délivrent correctement les protéines peut aider à éclairer notre compréhension de base du bon fonctionnement cellulaire et de ce qui peut mal se passer dans des maladies telles que le cancer, le diabète de type 2, les maladies neurodégénératives et les troubles immunitaires.
“Comprendre ces processus fondamentaux et les systèmes de régulation qui existent dans les cellules peut finalement ouvrir la voie au développement d'approches plus rationnelles d'intervention contre la maladie”, explique Audhya.
Plus d'information:
William Kasberg et al, La privation de nutriments modifie le taux de recrutement des sous-unités COPII dans les sous-domaines ER pour ajuster le transport des protéines sécrétoires, Communications naturelles(2023). DOI : 10.1038/s41467-023-44002-7
Fourni par l'Université du Wisconsin-Madison
Citation: Des scientifiques révèlent le fonctionnement interne d'un complexe de transport de protéines essentielles (3 janvier 2024) récupéré le 3 janvier 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.

