par Centre de recherche CeMM pour la médecine moléculaire de l’Académie autrichienne des sciences
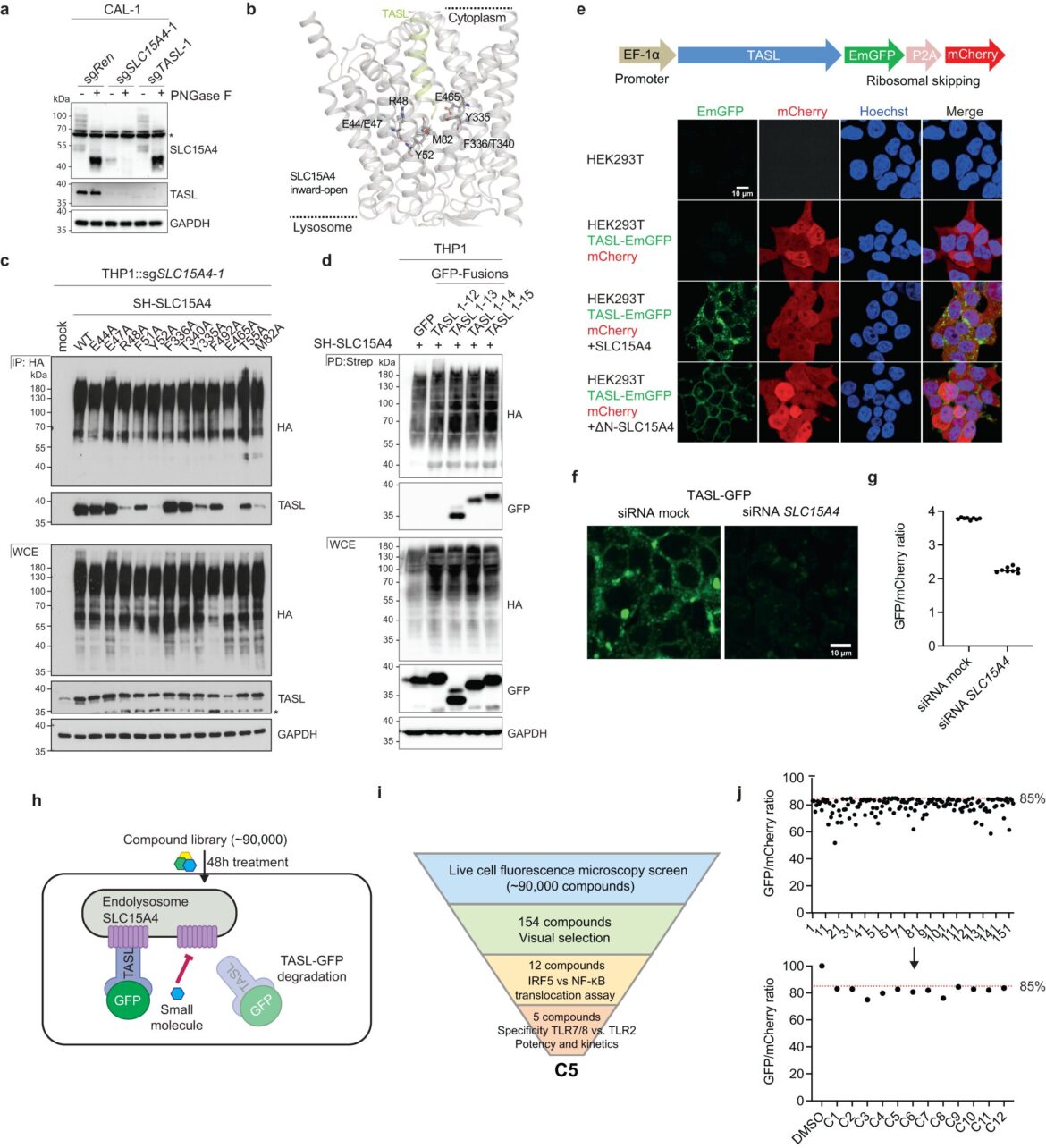
Interface de liaison SLC15A4-TASL et criblage de médicaments pour la stabilité de TASL. Crédit: Communications naturelles (2023). DOI : 10.1038/s41467-023-42070-3
Des scientifiques du CeMM, de l’Université de médecine de Vienne et de l’Université de Lausanne ont réussi pour la première fois à identifier et à caractériser une nouvelle petite molécule appelée “Feeblin”, capable d’inhiber l’interaction de la protéine transporteuse SLC15A4 avec la protéine adaptatrice TASL. Les deux protéines font partie des voies de signalisation proinflammatoires dans le corps. En particulier, les patients atteints de maladies auto-immunes telles que le lupus systémique (LED) pourraient bénéficier de l’inhibition de la voie de signalisation.
L’étude est publiée dans la revue Communications naturelles.
Dans les maladies auto-immunes, l’inflammation est chronique et entraîne de graves lésions tissulaires. Plusieurs voies moléculaires complexes sont impliquées dans ce processus, mais les thérapies et les médicaments ciblant des parties spécifiques de ces voies restent rares.
Giulio Superti-Furga, chercheur principal et directeur scientifique du centre de recherche CeMM pour la médecine moléculaire de l’Académie autrichienne des sciences, dans une étude de 2020 publiée dans Natureont identifié qu’une nouvelle protéine adaptatrice appelée TASL joue un rôle essentiel dans la transduction du signal du transporteur membranaire endo-lysosomal SLC15A4 et des récepteurs Toll-like 7 et 9 – acteurs centraux de la défense immunitaire innée – vers le facteur de transcription pro-inflammatoire IRF5 (interféron -facteur réglementaire 5).
À partir de ces résultats, le groupe a émis l’hypothèse que la régulation de SLC15A4 et TASL pourrait être un aspect important de la signalisation immunitaire qui pourrait être thérapeutiquement ciblée pour améliorer le LED. Giulio Superti-Furga et son équipe ont désormais franchi une étape importante vers la réalisation de cet objectif et se sont lancés dans une initiative de découverte de médicaments qui s’appuie sur l’expertise du groupe en matière de transporteurs de solutés et de découverte de médicaments.
Découverte de Feeblin
Pour leur étude, les scientifiques ont développé une nouvelle méthode de test qui peut être utilisée pour surveiller spécifiquement la présence de TASL. Si TASL n’est pas lié à SLC15A4, il est très instable. En travaillant avec la plateforme de découverte moléculaire CeMM, Andras Boeszoermenyi, auteur de l’étude et chercheur postdoctoral au laboratoire de Superti-Furga, a identifié une petite molécule régulant la stabilité de la protéine TASL et a découvert que cela dépendait de la présence de SLC15A4.
Le composé nouvellement découvert appelé Feeblin a réalisé exactement ce que l’équipe avait supposé ; le composé a désactivé la signalisation pro-inflammatoire médiée par IRF5.
Le composé doit son nom aux travaux du lauréat du prix Nobel Bruce Beutler sur les mutations de la signalisation SLC15A4 ; les souches de souris mutantes résultantes ont été qualifiées de « faibles ».
“Les résultats confirment les connaissances que nous avons acquises depuis que nous avons découvert le complexe SLC15A4-TASL et imaginé comment le cibler. Cela conforte notre conviction dans l’utilisation de Feeblin pour ouvrir de nouvelles options de traitement aux patients atteints de maladies auto-immunes”, a déclaré Manuele Rebsamen, ancien directeur de recherche. scientifique au sein du groupe Superti-Furga au CeMM et aujourd’hui professeur assistant à l’Université de Lausanne. Son équipe a aidé à élucider l’action du complexe.
Dans une étude parallèle, l’équipe de Maojun Yang de l’Université Tsinghua a élucidé la structure au microscope cryoélectronique de SLC15A4 et a révélé que SLC15A4 subit des changements conformationnels majeurs lors de la liaison à TASL. En collaboration avec l’équipe autour de Superti-Furga, le laboratoire Yang a confirmé l’interaction de Feeblin avec SLC15A4 et précisé son mécanisme allostérique.
Du candidat-médicament au nouveau médicament
Le chef du projet, Giulio Superti-Furga, explique : « C’est une histoire merveilleuse. Nous avons identifié ce nouvel adaptateur pour l’immunité innée, TASL, qui se lie à SLC15A4 et est essentiel pour la voie de signalisation IRF5, et en seulement trois ans, nous avons pu identifier un médicament. candidat doté d’un mécanisme d’action jusqu’alors totalement inconnu, un régulateur allostérique des interactions protéiques.
La validation du composé dans des conditions physiologiques a été réalisée par l’équipe de Leonhard Heinz, chef de groupe au département de rhumatologie de l’université de médecine de Vienne et également ancien membre de l’équipe Superti-Furga.
« Il existe un besoin médical important non satisfait dans le domaine du lupus, et il est très gratifiant de voir comment un mécanisme que nous avons aidé CeMM à découvrir se révèle désormais prometteur sous la forme d’un composé présent dans les cellules de patients atteints de LED. Nous espérons que cela se traduira par un nouveau traitement. options dans les années à venir”, déclare Leonhard Heinz.
Plus d’information:
Andras Boeszoermenyi et al, Un inhibiteur de conformation-verrouillage de SLC15A4 avec une activité anti-inflammatoire protéostatique TASL, Communications naturelles (2023). DOI : 10.1038/s41467-023-42070-3
Fourni par le Centre de recherche CeMM pour la médecine moléculaire de l’Académie autrichienne des sciences
Citation: Un composé nouvellement découvert bloque la voie de signalisation de la réponse immunitaire (24 octobre 2023) récupéré le 24 octobre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.