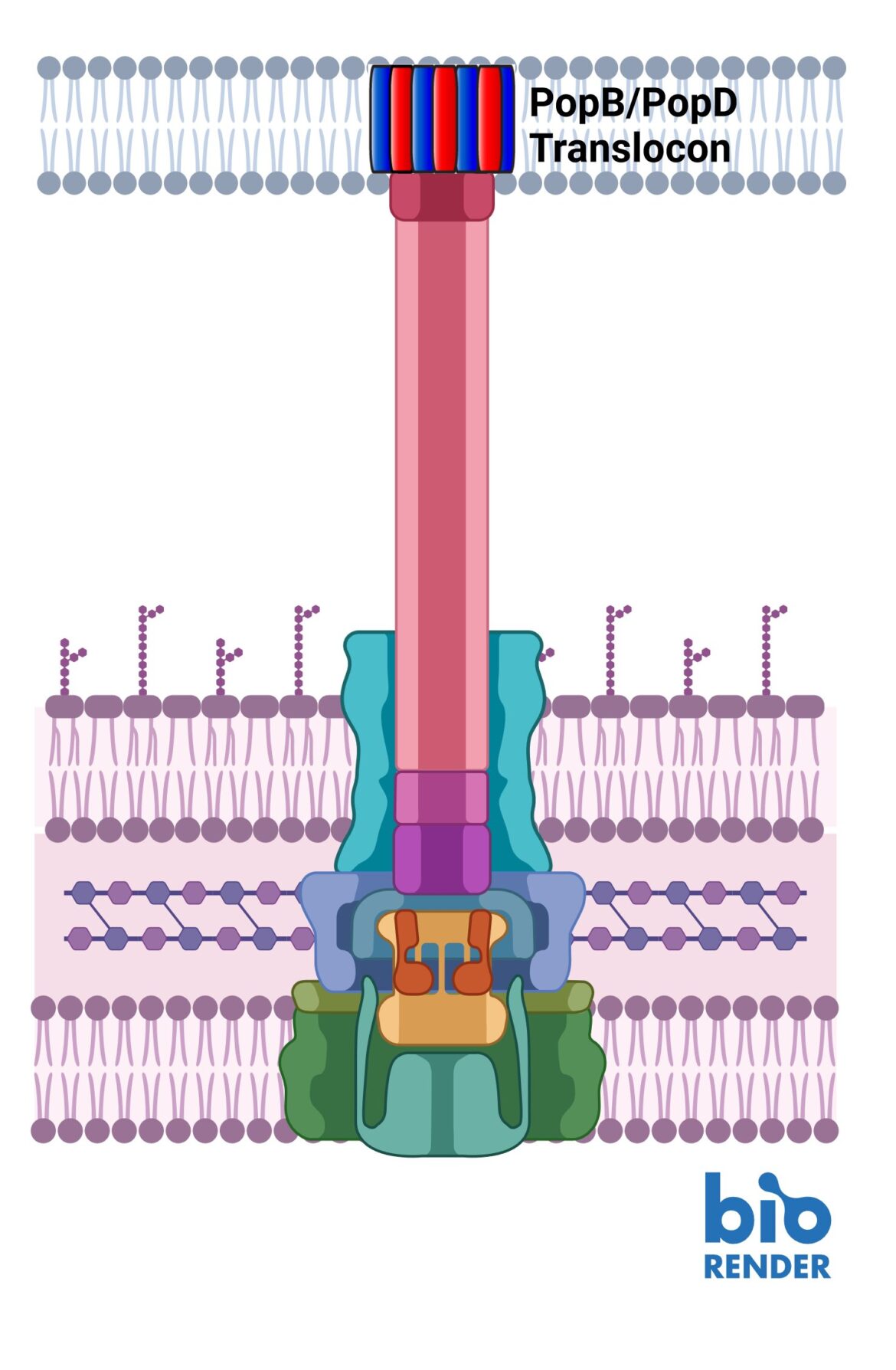
Le système de sécrétion de type 3 dépend de deux protéines, PopB et PopD (rouge et bleue) créant un tunnel dans la paroi cellulaire de l'hôte. Crédit : UMass Amherst
Les « superbactéries » résistantes aux antibiotiques qui peuvent contrecarrer les efforts visant à les tuer constituent une crise de santé publique urgente et, selon les Centers for Disease Control, plus de 2,8 millions d'infections résistantes aux antibiotiques surviennent chaque année. Les chercheurs du monde entier se démènent pour relever ce défi.
Une équipe collaborative de chercheurs dirigée par l'Université du Massachusetts Amherst et comprenant des scientifiques de la société biopharmaceutique Microbiotix a récemment annoncé avoir appris avec succès comment saboter un élément clé de la machinerie utilisée par les agents pathogènes pour infecter leurs cellules hôtes, et a développé un test pour identifier les médicaments de nouvelle génération pour cibler cette machinerie cellulaire vulnérable et réaliser de réels progrès en matière de santé publique.
La stratégie typique lors du traitement des infections microbiennes consiste à éliminer l’agent pathogène avec un antibiotique, qui agit en pénétrant à l’intérieur de la cellule nocive et en la tuant. Ce n’est pas aussi simple qu’il y paraît, car tout nouvel antibiotique doit être à la fois soluble dans l’eau, afin de pouvoir circuler facilement dans la circulation sanguine, et huileux, afin de traverser la première ligne de défense de la cellule pathogène, la membrane cellulaire. Bien entendu, l’eau et l’huile ne font pas bon ménage et il est difficile de concevoir un médicament qui possède suffisamment de ces deux caractéristiques pour être efficace.
La difficulté ne s’arrête pas là non plus, car les cellules pathogènes ont développé ce qu’on appelle une « pompe à efflux », capable de reconnaître les antibiotiques et de les excréter en toute sécurité hors de la cellule, où ils ne peuvent causer aucun dommage. Si l'antibiotique ne peut pas vaincre la pompe à efflux et tuer la cellule, alors l'agent pathogène « se souvient » de l'apparence de cet antibiotique spécifique et développe des pompes à efflux supplémentaires pour le gérer efficacement, devenant ainsi résistant à cet antibiotique particulier.
Une voie à suivre consiste à trouver un nouvel antibiotique, ou une combinaison de ceux-ci, et à essayer de garder une longueur d’avance sur les superbactéries.
“Ou bien, nous pouvons modifier notre stratégie”, déclare Alejandro Heuck, professeur agrégé de biochimie et de biologie moléculaire à l'UMass Amherst et auteur principal de l'article. « Je suis chimiste et j'ai toujours été très intéressé par la compréhension de la manière dont les molécules chimiques interagissent avec les organismes vivants. J'ai notamment axé mes recherches sur les molécules qui permettent la communication entre un pathogène et la cellule hôte qu'il souhaite combattre. envahir.”
Heuck et ses collègues se sont particulièrement intéressés à un système de communication appelé système de sécrétion de type 3, qui, jusqu'à présent, semble être une adaptation évolutive unique aux microbes pathogènes.
Comme la cellule pathogène, les cellules hôtes possèdent également des parois cellulaires épaisses et difficiles à pénétrer. Afin de les franchir, les agents pathogènes ont développé une machine semblable à une seringue qui sécrète d'abord deux protéines, connues sous le nom de PopD et PopB. Ni PopD ni PopB ne peuvent individuellement percer la paroi cellulaire, mais les deux protéines peuvent créer ensemble un « translocon », l'équivalent cellulaire d'un tunnel à travers la membrane cellulaire. Une fois le tunnel établi, la cellule pathogène peut injecter d’autres protéines qui effectuent le travail d’infecter l’hôte.
L’ensemble de ce processus est appelé système de sécrétion de type 3 et rien de tout cela ne fonctionne sans PopB et PopD. “Si nous n'essayons pas de tuer l'agent pathogène”, explique Heuck, “il n'y a aucune chance qu'il développe une résistance. Nous sabotons simplement sa machine. L'agent pathogène est toujours vivant ; il est tout simplement inefficace et l'hôte a le temps. utiliser ses défenses naturelles pour se débarrasser du pathogène.”
La question est alors de savoir comment trouver la molécule capable de bloquer l’assemblage du translocon ?
Parfois, les scientifiques trouvent des solutions dans ces « moments d’éclair » où tout prend tout à coup un sens. Dans ce cas, il s’agissait plutôt d’un moment de bug éclair.
Heuck et ses collègues ont réalisé qu'une classe d'enzymes appelées luciférases, similaires à celles qui font briller les éclairs la nuit, pouvait être utilisée comme traceur. Ils divisent l’enzyme en deux moitiés. Une moitié est entrée dans les protéines PopD/PopB et l’autre moitié a été modifiée dans une cellule hôte.
Ces protéines et hôtes modifiés peuvent être inondés de différents composés chimiques. Si la cellule hôte s’allume soudainement, cela signifie que PopD/PopB a réussi à percer la paroi cellulaire, réunissant les deux moitiés de la luciférase, les faisant briller. Mais si les cellules restent sombres ? “Nous savons alors quelles molécules brisent le translocon”, explique Heuck.
Heuck s'empresse de souligner que les recherches de son équipe ont non seulement des applications évidentes dans le monde des produits pharmaceutiques et de la santé publique, mais qu'elles font également progresser notre compréhension de la manière exacte dont les microbes infectent les cellules saines. “Nous voulions étudier le fonctionnement des agents pathogènes”, dit-il, “et puis, tout à coup, nous avons découvert que nos résultats pouvaient aider à résoudre un problème de santé publique.”
Cette recherche est publiée dans la revue Maladies infectieuses SCA.
Plus d'information:
Hanling Guo et al, Test basé sur des cellules pour déterminer l'assemblage de translocon du système de sécrétion de type 3 chez Pseudomonas aeruginosa à l'aide de la luciférase divisée, Maladies infectieuses SCA (2023). DOI : 10.1021/acsinfecdis.3c00482
Fourni par l'Université du Massachusetts Amherst
Citation: Une équipe de recherche découvre comment saboter les « superbactéries » résistantes aux antibiotiques (18 décembre 2023) récupéré le 19 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.