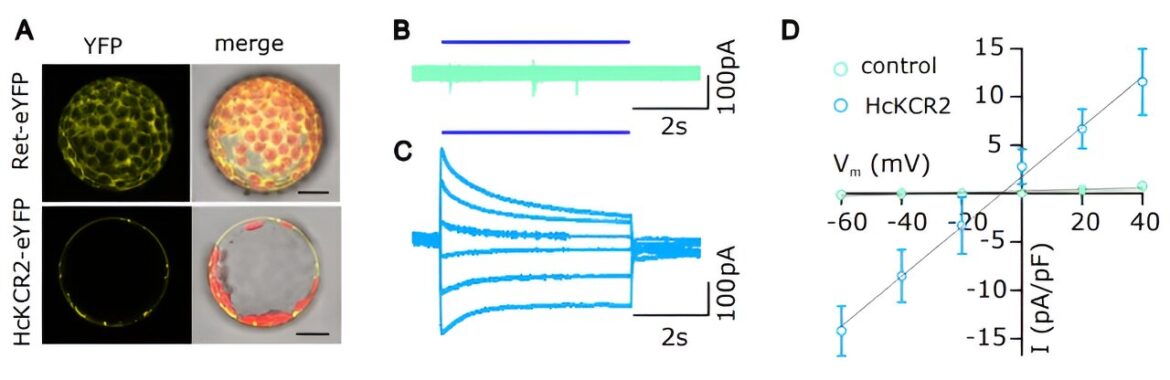
HcKCR2 est fonctionnel dans les cellules végétales A. Images confocales de protoplastes de N. benthamiana exprimant soit le HcKCR2 marqué par eYFP, soit le contrôle (Ret-eYFP), capturées 48 heures après la transformation transitoire. AVANT JC. Courants de cellules entières enregistrés dans des expériences de patch-clamp avec des protoplastes de N. benthamiana transformés avec une construction témoin (B) ou avec HcKCR2 (C). Les cellules ont été maintenues à un potentiel de maintien de -60 mV et testées par étapes de 40 à -60 mV, avec des décréments de 20 mV, pendant 8 secondes. Une impulsion BL de 5 s (λ = 490 nm, 5 mW/mm2) a été imposé à chaque échelon de tension. D. Relation IV entre contrôle et protoplastes exprimant HcKCR2. Crédit: Science (2023). DOI : 10.1126/science.adj9696
Grâce à l'optogénétique, les chercheurs de Würzburg ont détecté un nouveau capteur d'acide dans les cellules végétales qui s'adresse aux réserves de calcium internes aux cellules. L'étude est publiée dans la revue Science.
Lorsque les plantes sont infectées par des agents pathogènes, souffrent d'un manque d'eau ou doivent réagir à d'autres stimuli externes, la première chose qu'elles font est d'augmenter la concentration de protons et de calcium dans les cellules affectées. Les protons et les ions calcium agissent alors comme des substances messagères qui déclenchent d’autres réactions dans la cellule.
Les interactions entre les protons et les ions calcium dans ce processus étaient auparavant largement inconnues. La nouvelle étude menée par une équipe dirigée par le professeur biophysicien Rainer Hedrich de la Julius-Maximilians-Universität (JMU) de Würzburg en Bavière, en Allemagne, a apporté un nouvel éclairage sur ce sujet.
Grâce à une approche optogénétique sophistiquée, les chercheurs ont découvert un capteur d'acide endogène jusqu'alors inconnu dans les cellules végétales. Et ils ont découvert dans les cellules de garde des feuilles qu’il existe une réserve de calcium qui joue un rôle important dans le traitement des signaux protoniques dans les réponses cellulaires.
Pourquoi des éléments aussi simples que les protons et les ions calcium agissent comme des signaux
Au cours de l’évolution, les cellules ont conçu leur métabolisme pour utiliser les phosphates riches en énergie. Cela pose un problème : à un pH cellulaire majoritairement neutre, les précieux phosphates peuvent être liés par des ions calcium (Ca2+) et transformé en une forme insoluble et donc inutilisable (phosphate dihydrogène de calcium).
Pour éviter cela, les cellules maintiennent leur taux de calcium interne très bas. Or, dans leur environnement, il est 10 000 fois plus élevé. En dehors des cellules, la concentration de protons (H+) et donc l'acidité est également beaucoup plus élevée. En raison de ce gradient de concentration, les deux types d’ions ont un fort besoin de circuler dans les cellules, ce qui les rend idéaux pour être utilisés comme substances messagères.
“L'ouverture des canaux calciques et protoniques dans la membrane cellulaire, dépendante du stimulus, entraîne une augmentation intracellulaire temporaire des deux ions messagers”, explique Hedrich. “Les cellules comprennent cela comme un signal qu'elles traduisent en une réaction biologique utilisant des enzymes liant le calcium et les protons.”
L'interrupteur d'éclairage contrôle le flux de protons dans la cellule
Comment les cellules végétales réagissent-elles à l’afflux de protons et à l’acidification de leur plasma cellulaire qui en découle ? Jusqu’à présent, cela ne pouvait être étudié qu’au prix d’un grand effort expérimental et même indirectement.
Cela est désormais beaucoup plus facile grâce à un thale cress (Arabidopsis thaliana) équipé de manière appropriée, que l'équipe de Hedrich a développé à l'aide de méthodes optogénétiques : un canal protonique sensible à la lumière provenant d'un champignon, le canal rhodopsine KCR2, a été optimisé pour une utilisation dans les cellules végétales. Cela signifie que des protons peuvent désormais être spécifiquement envoyés dans les cellules en réponse à une impulsion lumineuse. De plus, ils ont exprimé KCR2 avec le rapporteur de pH génétiquement codé pHuji. Cela rend très facile la mesure de la valeur actuelle du pH dans la cellule lors de l’activation de KCR2.
Shouguang Huang, le premier auteur du Science publication, a ensuite examiné les cellules de garde du nouveau mutant Arabidopsis. “Lorsque je les ai stimulés avec de la lumière bleue pendant une seconde, ils se sont dépolarisés, exactement comme je m'y attendais d'un canal à protons activé par la lumière”, explique le chercheur. Au cours des expériences ultérieures, les spécialistes des canaux ioniques de Würzburg ont fait une découverte de grande envergure.
L'activation de KCR2 acidifie la cellule et fait augmenter le calcium
Leurs études électrophysiologiques sur les cellules de garde ont montré que lorsque la stimulation lumineuse commençait, le potentiel membranaire se dépolarisait immédiatement et le rapporteur de pH pHuji signalait une acidification de l'intérieur des cellules.
“Cependant, nous avons été étonnés de constater que la dépolarisation et l'acidification se sont poursuivies pendant une bonne minute après la fin de l'impulsion lumineuse”, explique Hedrich. “Cela pourrait seulement signifier que l'activation lumineuse de KCR2 et l'acidification avaient activé les propres canaux ioniques des cellules du sphincter.” Il s’agit des canaux anioniques des cellules de garde, SLAC1 et SLAH3, connus depuis longtemps, dont l’activation nécessite cependant également la présence de calcium.
Réticulum endoplasmique comme réserve de calcium
“En prenant tous les faits ensemble, on pourrait supposer que les courants de protons transportés par KCR2 et l'acidification associée de l'intérieur des cellules doivent également avoir généré un signal calcique”, résume le professeur du JMU.
Son équipe a pu prouver que l'acidification rapide des cellules de garde est suivie d'un signal calcique qui dure 150 à 200 secondes. Et ils ont découvert que ce calcium ne vient pas de l’extérieur de la cellule, mais est libéré d’une réserve endogène, le réticulum endoplasmique. Il s’agit d’un réseau de tubes membranaires et de citernes qui parcourent le cytoplasme.
Les futures études se concentreront désormais sur l'analyse de la nature moléculaire du H+-canal calcique sensible du réticulum endoplasmique et enquête sur son interrupteur marche/arrêt activé par les protons. Dans l’ensemble, ces études sont importantes pour mieux comprendre comment les cellules végétales réagissent aux stimuli externes tels que les infections ou la sécheresse.
Plus d'information:
Shouguang Huang et al, La canalrhodopsine photosensible déclenche la libération de calcium induite par des protons dans les cellules de garde, Science (2023). DOI : 10.1126/science.adj9696
Fourni par Julius-Maximilians-Universität Würzburg
Citation: Une étude optogénétique détecte un nouveau capteur d'acide dans les cellules végétales (15 décembre 2023) récupéré le 15 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.