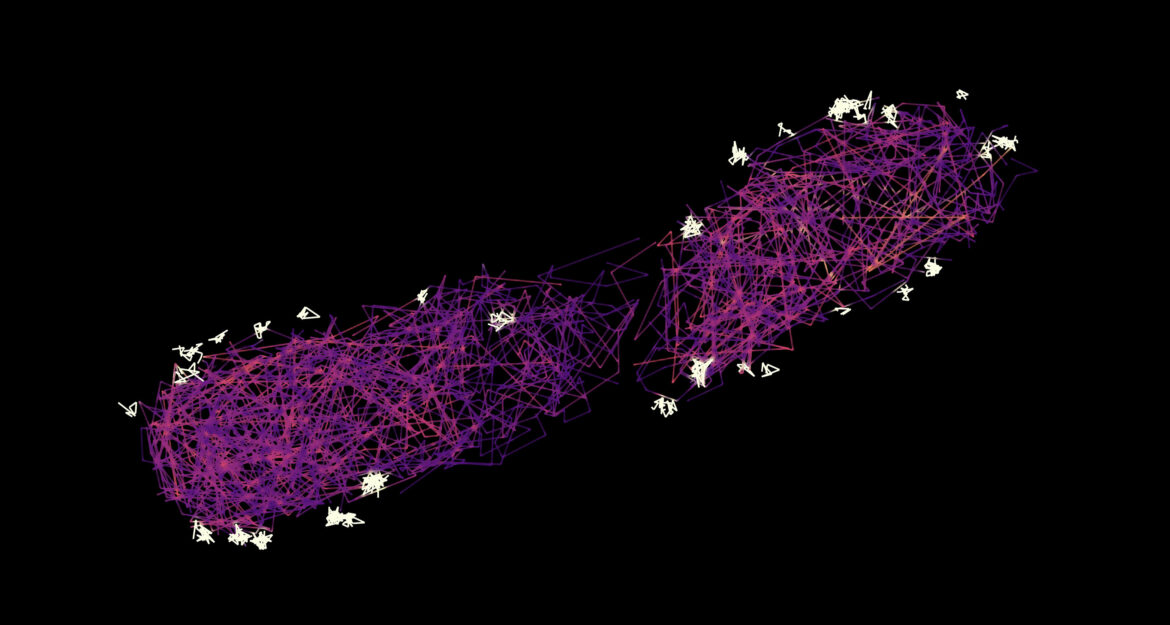
La microscopie de localisation photoactivée par suivi de particules uniques (sptPALM) est une technique permettant de visualiser le mouvement de protéines individuelles. Alors que certains des composants navettes de l'injectisome sont liés aux aiguilles (points blancs fermement liés à l'extérieur de la bactérie), d'autres protéines navettes traversent la bactérie (ombrages rouges et bleus). S'ils rencontrent un effecteur, ils s'y attachent, ce qui se reconnaît au fait qu'ils ralentissent, et le délivrent aux aiguilles, d'où une nouvelle protéine navette se lance à sa recherche. Crédit : Stephan Wimmi/Alexander Balinovic
Les bactéries pathogènes du genre Salmonella ou Yersinia peuvent utiliser de minuscules appareils d'injection pour injecter des protéines nocives dans les cellules hôtes, au grand désagrément de la personne infectée. Cependant, ce n'est pas seulement dans l'optique de contrôler la maladie que les chercheurs étudient le mécanisme d'injection de ces systèmes de sécrétion dits de type III, également appelés « injectisomes ».
Si la structure et la fonction de l’injectisome étaient parfaitement comprises, les chercheurs pourraient le détourner pour administrer des médicaments spécifiques dans des cellules, telles que les cellules cancéreuses. En fait, la structure de l’injectisome a déjà été élucidée. Cependant, on ne sait toujours pas comment les bactéries chargent leurs seringues pour que les bonnes protéines soient injectées au bon moment.
Composants mobiles de la recherche de protéines par injectisome
Dans une étude publiée dans Microbiologie naturelle, une équipe de scientifiques dirigée par Andreas Diepold de l'Institut Max Planck de microbiologie terrestre de Marburg et Ulrike Endesfelder de l'Université de Bonn a désormais pu répondre à cette question : les composants mobiles du peigne injectisome à travers la cellule bactérienne à la recherche du protéines à injecter, appelées effecteurs. Lorsqu’ils rencontrent un effecteur, ils le transportent comme une navette jusqu’à la porte de l’aiguille d’injection.
“La façon dont les protéines de la plate-forme de tri dans le cytosol se lient aux effecteurs et livrent la cargaison à la porte d'exportation de l'injectisome lié à la membrane est comparable aux processus d'un terminal de fret”, explique Stephan Wimmi, premier auteur de l'étude en tant que chercheur postdoctoral. chercheur au laboratoire d'Andreas Diepold.
“Nous pensons que ce mécanisme de navette contribue à rendre l'injection efficace et spécifique à la fois. Après tout, les bactéries doivent injecter rapidement les bonnes protéines pour éviter d'être reconnues et éliminées par le système immunitaire, par exemple.”
Pour mieux comprendre l’important mécanisme de chargement de l’injectisome, les chercheurs ont dû appliquer de nouvelles techniques. “Les méthodes conventionnelles, qui sont normalement utilisées pour détecter que les protéines se lient les unes aux autres, n'ont pas permis de répondre à cette question, peut-être parce que les effecteurs ne sont liés que pendant une courte période puis immédiatement injectés”, explique Andreas Diepold, chef du groupe de recherche à l'Institut Max Planck et co-responsable de l'étude. “C'est pourquoi nous avons dû analyser cette liaison in situ chez les bactéries vivantes.”
“Pour mesurer ces interactions transitoires, nous avons utilisé deux nouvelles approches efficaces dans les cellules vivantes, le marquage de proximité et le suivi d'une seule particule”, ajoute Ulrike Endesfelder, dont le groupe a travaillé sur l'étude dans trois endroits différents : l'Institut Max Planck de Marburg. , à l'Université Carnegie Mellon de Pittsburgh et à l'Université de Bonn.
Le marquage de proximité, par lequel une protéine marque ses voisines immédiates comme un pinceau, a permis de montrer que les effecteurs de la bactérie se lient aux composants injectisomes mobiles. Cette liaison a été examinée plus en détail à l’aide du suivi de particules uniques, une méthode de microscopie à haute résolution permettant de suivre des protéines individuelles dans les cellules. Ces méthodes, que l'équipe appelle « biochimie in situ », c'est-à-dire des investigations biochimiques sur place, ont rendu cette avancée possible.
Les chercheurs souhaitent ensuite utiliser leur méthode pour étudier d’autres mécanismes utilisés par les bactéries pour provoquer des infections. “Plus nous en savons sur la manière dont les bactéries utilisent ces systèmes lors d'une infection, mieux nous pouvons comprendre comment nous pouvons les influencer, que ce soit pour prévenir les infections ou pour modifier les systèmes afin de les utiliser dans les domaines de la médecine ou de la biotechnologie.” dit Diepold.
Plus d'information:
La plate-forme de tri cytosolique complexe les effecteurs du système de sécrétion de type III vers l'injectisome chez Yersinia enterocolitica., Microbiologie naturelle (2024). DOI : 10.1038/s41564-023-01545-1
Fourni par la Société Max Planck
Citation: Les bactéries pathogènes utilisent des « services de navette » moléculaires pour remplir leur appareil d'injection avec le bon produit (3 janvier 2024) récupéré le 3 janvier 2024 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.