Prédiction de la structure de la structure en forme d'anneau nucléoprotéique (NP) en complexe avec la protéine matricielle Z (à gauche). L'ARN peut induire la dissociation du trimère NP, ce qui permet les assemblages NP-ARN. Spectre de masse natif du complexe NP-Z, le trimère NP et la protéine Z étant détectables (à droite). Crédit: Journal de l'American Chemical Society (2023). DOI : 10.1021/jacs.3c07325
Le virus Lassa (LASV) est l'agent pathogène responsable de la fièvre hémorragique de Lassa, une maladie endémique en Afrique de l'Ouest, qui provoque environ 5 000 décès chaque année. Au Centre CSSB de biologie des systèmes structurels, les groupes d'Uetrecht (CSSB, LIV, Uni Siegen), Kosinski (CSSB, EMBL) et Rosenthal (BNITM, CSSB) ont travaillé ensemble pour révéler le rôle crucial joué par l'ARN dans les étapes critiques du Lassa. cycle de vie du virus.
Leurs conclusions sont publiées dans le Journal de l'American Chemical Society.
Dans le corps humain, 20 000 gènes produisent plus d’un million de formes différentes de protéines. En comparaison, le virus Lassa est minuscule car il est composé de seulement quatre protéines, appelées L, NP, Z et GPC.
“Nous essayons de comprendre comment ces quatre protéines peuvent causer des dommages aussi graves aux cellules humaines”, explique Lennart Sänger, premier auteur de l'article. “Les activités et l'expression de ces protéines doivent être étroitement régulées et les protéines doivent communiquer efficacement entre elles pour assumer différentes fonctions.”
Pour protéger et cacher le virus de la détection par le système immunitaire, la nucléoprotéine (NP) enferme le génome viral dans une capside. Cette capside, avec l'ARN viral et la protéine L, forme des complexes ribonucléoprotéiques (RNP).
Pour propager l’infection, les RNP doivent continuellement se restructurer afin de permettre la réplication et la transcription du génome viral. Les chercheurs ont étudié les interactions entre le NP et l’ARN viral ainsi que la protéine Z pour mieux comprendre le mécanisme et la dynamique de la formation et de l’emballage des RNP dans de nouvelles particules virales.
Utilisant la spectrométrie de masse structurale, une méthode qui agit comme une échelle moléculaire en révélant le poids atomique des interactions moléculaires, les chercheurs ont examiné la dynamique entre le NP et l'ARN viral. “Au départ, la protéine NP n'existe pas dans une composition capable de lier l'ARN viral”, explique Charlotte Uetrecht, responsable du groupe CSSB et experte en techniques de spectrométrie de masse.
“Un changement doit se produire pour permettre cette liaison et nous avons découvert que l'ARN viral peut initier ce changement par lui-même.” Les chercheurs ont identifié l’ARN comme le moteur du désassemblage des trimères NP annulaires en monomères qui sont ensuite capables de former des assemblages NP liés à l’ARN d’ordre supérieur.
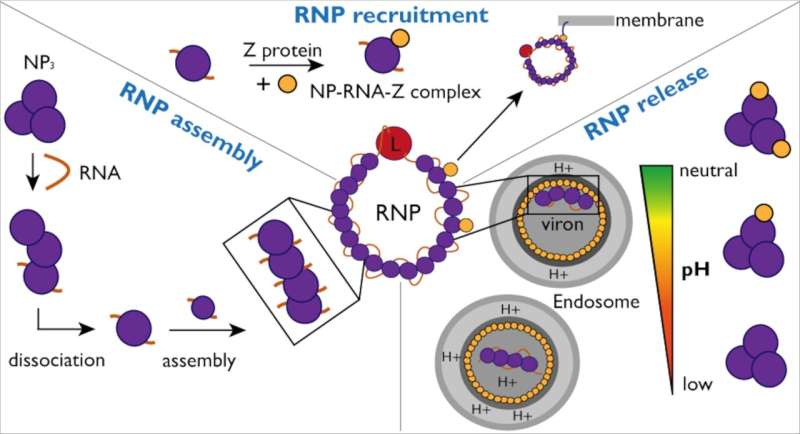
Étapes critiques du cycle de vie de la ribonucléoparticule du virus Lassa (RNP). Assemblage RNP : un ARN d’une longueur critique est le facteur suffisant pour piloter l’assemblage NP-ARN en initiant le désassemblage du trimère NP et l’assemblage du monomère NP-ARN. Recrutement de RNP : Z peut se lier directement au NP et indépendamment de l'ARN, ce qui peut faciliter le recrutement de RNP à la membrane cellulaire. Libération de RNP : l’interaction NP-Z dépend fortement du pH. L'interaction est réduite au pH de l'endosomal, ce qui pourrait être un facteur de libération de RNP par la matrice virale. Crédit: Journal de l'American Chemical Society (2023). DOI : 10.1021/jacs.3c07325
Les chercheurs ont également étudié plus en détail l’interaction du NP avec la protéine Z. Pour faciliter cela, le groupe Kosinski a utilisé AlphaFold pour prédire le site d'interaction du complexe NP-Z. Ces prédictions ont ensuite été vérifiées par les chercheurs du laboratoire.
“L'utilisation de l'intelligence artificielle nous a permis d'identifier rapidement des interactions possibles et nous a également permis de créer des mutants pour vérifier notre hypothèse”, note Jan Kosinski. Les chercheurs ont finalement pu démontrer que même si le NP lie Z indépendamment de la présence d’ARN, cette interaction dépend du pH.
“Dans l'ensemble, ces résultats contribuent à améliorer notre compréhension de l'assemblage, du recrutement et de la libération des RNP dans le virus Lassa”, explique Maria Rosenthal, experte en virus Lassa à l'Institut Bernhard Nocht de médecine tropicale et membre associé du CSSB. En Afrique de l’Ouest, 186 millions de personnes risquent d’être infectées par le virus de Lassa d’ici 2030, et l’Organisation mondiale de la santé reconnaît le virus de Lassa comme un agent pathogène dangereux et encore peu étudié.
“Comprendre le fonctionnement du virus de Lassa pourrait à terme nous permettre de développer des molécules qui pourraient inhiber la réplication de ce virus et traiter la fièvre de Lassa”, note Rosenthal.
Plus d'information:
Lennart Sänger et al, L'ARN pour les gouverner tous : étapes critiques dans l'assemblage et le recrutement des ribonucléoparticules du virus Lassa, Journal de l'American Chemical Society (2023). DOI : 10.1021/jacs.3c07325
Fourni par le Centre CSSB de biologie des systèmes structuraux
Citation: Une nouvelle recherche révèle des étapes critiques dans l'assemblage et le recrutement des ribonucléoparticules du virus Lassa (21 décembre 2023) récupéré le 22 décembre 2023 sur
Ce document est soumis au droit d'auteur. En dehors de toute utilisation équitable à des fins d'étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.

