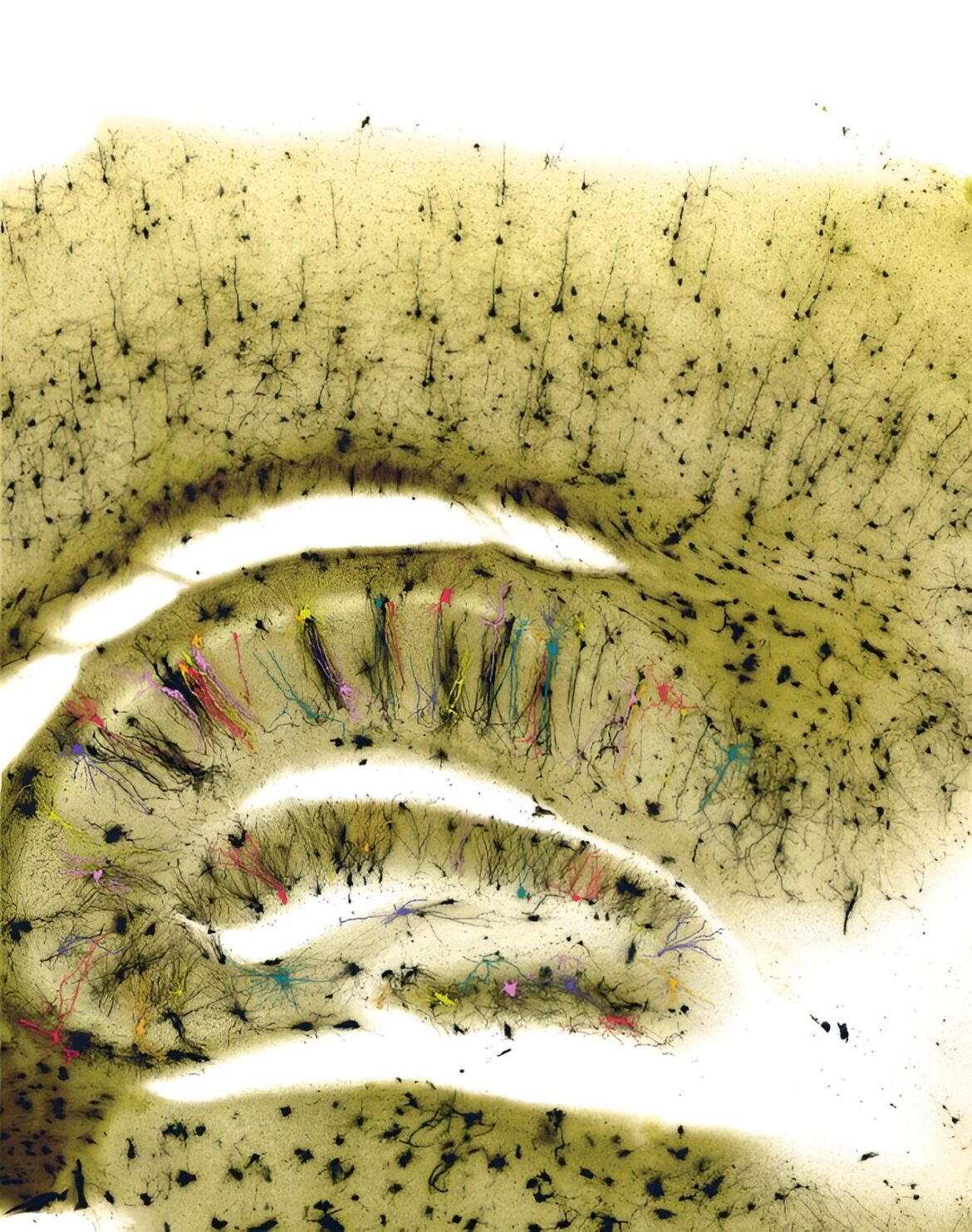
Cette image, obtenue à partir d’un cerveau de souris à l’aide d’un microscope à fond clair, montre les cellules richement diverses de l’hippocampe pseudocolorées avec différentes teintes. Maria Chahrour, Ph.D., et ses collègues ont étudié comment les cellules de l’hippocampe sont affectées dans les troubles du spectre autistique, montrant que des sous-types uniques de neurones excitateurs et inhibiteurs sont particulièrement vulnérables en cas de perte d’un gène autistique et d’un régulateur de la chromatine. Crédit : Centre médical UT Southwestern
Un gène précédemment lié au trouble du spectre autistique (TSA) par les chercheurs du UT Southwestern Medical Center semble jouer un rôle important dans l’orientation des cellules de l’hippocampe du cerveau vers leur identité ultime, a rapporté la même équipe dans une nouvelle étude. Les résultats, publiés dans Avancées scientifiquespourrait éventuellement conduire à de nouvelles thérapies pour le trouble neurodéveloppemental prévalent.
“Cette étude est l’une des rares à fournir une compréhension mécaniste des troubles du spectre autistique”, a déclaré l’auteure principale Maria Chahrour, Ph.D., professeure agrégée de neurosciences et de psychiatrie et chercheuse au Peter O’Donnell Jr. Brain Institute de UT Sud-Ouest.
Aux États-Unis, environ 1 enfant sur 36 reçoit un diagnostic de TSA, selon les Centers for Disease Control and Prevention. Soulignant le rôle important de la génétique dans les TSA, le Dr Chahrour a noté que les études sur les jumeaux suggèrent une héritabilité d’environ 90 %. Bien que des centaines de gènes associés aux TSA aient été identifiés, a-t-elle ajouté, la manière dont ces gènes pourraient contribuer à ce trouble reste largement inconnue.
En 2020, le Dr Chahrour et ses collègues ont découvert un gène associé aux TSA appelé KDM5A, démontrant que les patients porteurs de mutations de ce gène souffrent généralement de TSA, d’un manque d’élocution, d’une déficience intellectuelle et d’autres symptômes. Bien que KDM5A soit connu pour coder pour un régulateur de la chromatine – une protéine qui affecte la façon dont l’ADN est conditionné dans les cellules et si d’autres gènes sont exprimés – le mécanisme derrière son rôle dans les TSA était inconnu.
Sachant que les régulateurs de la chromatine affectent l’identité cellulaire ou la manière dont les cellules se développent en types spécifiques, le Dr Chahrour et ses collègues se sont penchés sur l’assortiment de types cellulaires dans un modèle murin dans lequel ce gène avait été éliminé. Ils ont étudié spécifiquement le centre d’apprentissage et de mémoire du cerveau, l’hippocampe, dont la structure et la fonction sont altérées dans les TSA.
L’hippocampe comprend quatre types de cellules principaux : les neurones excitateurs, les neurones inhibiteurs, les cellules gliales et les cellules endothéliales, et ces quatre types sont divisés en 24 sous-types. En utilisant une technique connue sous le nom de séquençage d’ARN mononucléaire, les chercheurs ont séquencé plus de 105 000 noyaux pour comparer les populations de types de cellules présentes dans l’hippocampe chez les souris atteintes de KDM5A et les souris sans le gène, ou « knock-out ».
Leur analyse a montré des différences distinctes entre quatre sous-types de neurones excitateurs et deux sous-types de neurones inhibiteurs. Chez les souris sans KDM5A, certains de ces types de cellules ont augmenté en nombre, d’autres ont diminué et l’une d’entre elles est passée à un sous-type différent au sein de sa classe, ce qui suggère que KDM5A joue un rôle important dans la détermination de l’identité cellulaire au cours du développement.
Un examen plus approfondi des cellules dans les hippocampes des animaux knock-out KDM5A a montré que les cellules de cette zone semblaient plus matures, avec des cellules ramifiées anormalement plus nombreuses et plus longues que chez les animaux atteints de KDM5A. La plupart des cellules affectées résidaient dans une région de l’hippocampe connue sous le nom de CA1, clé du stockage des souvenirs sociaux ou des souvenirs d’interactions avec les autres.
Les changements dans les types de cellules peuvent entraîner des déséquilibres d’excitation et d’inhibition, et les défauts de développement cellulaire peuvent endommager les circuits hippocampiques et conduire à un dysfonctionnement de l’hippocampe, expliquant certains des symptômes associés aux TSA, a déclaré le Dr Chahrour.
Le Dr Chahrour, qui est également professeur agrégé au Centre Eugene McDermott pour la croissance et le développement humains et au Centre pour la génétique de la défense de l’hôte à l’UTSW, a déclaré que ces découvertes renforcent la mission vitale de son laboratoire : comprendre les mécanismes moléculaires sous-jacents aux TSA et conditions neurodéveloppementales associées.
Plus d’information:
Lauretta El Hayek et al, La perturbation du gène de l’autisme et du régulateur de la chromatine KDM5A modifie l’identité des cellules hippocampiques, Avancées scientifiques (2023). DOI : 10.1126/sciadv.adi0074
Fourni par le centre médical UT Southwestern
Citation: Le gène associé à l’autisme semble modifier l’identité des cellules cérébrales dans l’hippocampe (24 novembre 2023) récupéré le 24 novembre 2023 sur
Ce document est soumis au droit d’auteur. En dehors de toute utilisation équitable à des fins d’étude ou de recherche privée, aucune partie ne peut être reproduite sans autorisation écrite. Le contenu est fourni seulement pour information.